题目内容
H2S溶于水的电离方程式为 .
(1)向H2S溶液中加入浓盐酸时,电离平衡向 移动,c(H+) (填增大、减小、不变:下同),c(S2-) .
(2)向H2S溶液中加入NaOH固体,电离平衡向 移动,c(H+) ,c(S2-) .(3)若要使H2S溶液中c(HS-)增大,且使H2S的电离平衡逆向移动,可以加入 .(4)向H2S溶液中加水,c(HS-) ,溶液PH .
(1)向H2S溶液中加入浓盐酸时,电离平衡向
(2)向H2S溶液中加入NaOH固体,电离平衡向
考点:弱电解质在水溶液中的电离平衡
专题:电离平衡与溶液的pH专题
分析:H2S溶于水是多元弱酸溶液,存在电离平衡,多元弱酸分步电离;
(1)依据影响电离平衡的条件分析,加入浓盐酸,氢离子浓度增大,平衡左移;
(2)依据影响电离平衡的条件分析,向H2S溶液中加入NaOH固体,和氢离子发生中和反应,平衡正向进行;
(3)若要使H2S溶液中c(HS-)增大,电离平衡逆向进行,可以加入NaHS固体;
(4)加水稀释促进电离,离子浓度减小.
(1)依据影响电离平衡的条件分析,加入浓盐酸,氢离子浓度增大,平衡左移;
(2)依据影响电离平衡的条件分析,向H2S溶液中加入NaOH固体,和氢离子发生中和反应,平衡正向进行;
(3)若要使H2S溶液中c(HS-)增大,电离平衡逆向进行,可以加入NaHS固体;
(4)加水稀释促进电离,离子浓度减小.
解答:
解:H2S溶于水是多元弱酸溶液,存在电离平衡,多元弱酸分步电离,电离方程式为:H2S?H++HS-、HS-?H++S2-,
故答案为:H2S?H++HS-、HS-?H++S2-;
(1)H2S?H++HS-、HS-?H++S2-加入浓盐酸,氢离子浓度增大,平衡左移,氢离子浓度增大,硫离子浓度减小,
故答案为:左;增大;减小;
(2)H2S?H++HS-、HS-?H++S2-,向H2S溶液中加入NaOH固体会和氢离子反应,促进电离平衡正向进行,氢离子浓度减小,硫离子浓度增大,
故答案为:右;减小;增大;
(3)若要使H2S溶液中c(HS-)增大,且使H2S的电离平衡逆向移动,可以加入NaHS固体,硫氢根离子浓度增大,平衡逆向进行,
故答案为:NaHS固体;
(4)向H2S溶液中加水,稀释溶液促进电离,溶液中的离子浓度减小,c(HS-)浓度减小,溶液pH增大,
故答案为:减小;增大.
故答案为:H2S?H++HS-、HS-?H++S2-;
(1)H2S?H++HS-、HS-?H++S2-加入浓盐酸,氢离子浓度增大,平衡左移,氢离子浓度增大,硫离子浓度减小,
故答案为:左;增大;减小;
(2)H2S?H++HS-、HS-?H++S2-,向H2S溶液中加入NaOH固体会和氢离子反应,促进电离平衡正向进行,氢离子浓度减小,硫离子浓度增大,
故答案为:右;减小;增大;
(3)若要使H2S溶液中c(HS-)增大,且使H2S的电离平衡逆向移动,可以加入NaHS固体,硫氢根离子浓度增大,平衡逆向进行,
故答案为:NaHS固体;
(4)向H2S溶液中加水,稀释溶液促进电离,溶液中的离子浓度减小,c(HS-)浓度减小,溶液pH增大,
故答案为:减小;增大.
点评:本题考查了弱电解质电离平衡的影响因素分析,溶液稀释促进弱电解质电离而离子浓度减小,侧重于基础知识的考查,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
食用下列食品,通常不会对人体造成危害的是( )
| A、用甲醛溶液浸泡的海鲜品 |
| B、牛奶经工业发酵后得到的酸奶 |
| C、加有苏丹红Ⅰ号调色剂的鲜辣酱 |
| D、二氧化硫熏制后的白面粉? |
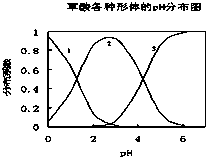 草酸(H2C2O4)是一种易溶于水的二元中强酸,在水中它的存在形态有H2C2O4、HC2O4-、C2O42-,各形态的分布系数(浓度分数)α随溶液pH变化的关系如图所示:
草酸(H2C2O4)是一种易溶于水的二元中强酸,在水中它的存在形态有H2C2O4、HC2O4-、C2O42-,各形态的分布系数(浓度分数)α随溶液pH变化的关系如图所示: