题目内容
有关叙述正确的是( )
| A、铝热剂就是单指Fe2O3和铝粉的混合物 |
| B、检验红色物质是否是Fe2O3的操作步骤为:样品-→粉碎-→加水溶解-→过滤-→向滤液中滴加KSCN溶液 |
| C、分别还原a mol Fe2O3所需提供的H2、Al、CO的物质的量之比为3:2:3 |
| D、明矾属硫酸盐,含结晶水,是纯净物 |
考点:镁、铝的重要化合物,酸、碱、盐、氧化物的概念及其相互联系,化学方程式的有关计算,二价Fe离子和三价Fe离子的检验
专题:元素及其化合物
分析:A.可以发生铝热反应的混合物称之为铝热剂;
B.Fe2O3不溶于水,且和水不反应;
C.amolFe2O3被还原得到6amol电子,根据还原剂的化合价变化判断;
D.含有结晶水的化合物为纯净物.
B.Fe2O3不溶于水,且和水不反应;
C.amolFe2O3被还原得到6amol电子,根据还原剂的化合价变化判断;
D.含有结晶水的化合物为纯净物.
解答:
解:A.作为铝热剂重要组成的金属氧化物,铝热剂应为Al和过渡元素的氧化物所形成的混合物,故A错误;
B.Fe2O3不溶于水,且和水不反应,应加入盐酸或稀硫酸溶解后再加KSCN溶液,Fe2O3的检验过程:样品→粉碎→加酸溶解→过滤→向滤液中滴加KSCN溶液,故B错误;
C.amolFe2O3被还原得到6amol电子,则分别消耗H2、Al、CO3amol、2amol、3amol,物质的量之比为3:2:3,故C错误;
D.明矾为KAl(SO4)2?12H2O,是结晶水化合物,属于硫酸盐,为纯净物,故D正确.
故选D.
B.Fe2O3不溶于水,且和水不反应,应加入盐酸或稀硫酸溶解后再加KSCN溶液,Fe2O3的检验过程:样品→粉碎→加酸溶解→过滤→向滤液中滴加KSCN溶液,故B错误;
C.amolFe2O3被还原得到6amol电子,则分别消耗H2、Al、CO3amol、2amol、3amol,物质的量之比为3:2:3,故C错误;
D.明矾为KAl(SO4)2?12H2O,是结晶水化合物,属于硫酸盐,为纯净物,故D正确.
故选D.
点评:本题综合考查元素化合物知识,涉及铝热剂、离子的检验、氧化还原反应以及纯净物与混合物的判断,题目难度中等,注意相关知识的积累.

练习册系列答案
相关题目
下列说法正确的是( )
| A、苯、水、四氯化碳三种无色液体不用试剂就可以鉴别开来 |
| B、甘氨酸既能与HCl反应又能与NaOH反应,所以甘氨酸是两性氧化物 |
| C、检验淀粉是否已完全水解,只需要向水解混合液中加银氨溶液并水浴加热即可 |
| D、等质量的C3H6、C4H10、C6H6完全燃烧,耗氧最多的是C6H6 |
C5H11OH经氧化后可生成相应的羧酸C4H9COOH的同分异构体最多有( )
| A、3种 | B、4种 | C、5种 | D、6种 |
除去铜粉中混有的少量氧化铜,其主要操作过程是( )
| A、加适量浓硫酸、微热、蒸发 |
| B、加适量稀硫酸、微热、过滤 |
| C、加适量水、微热、蒸发 |
| D、加适量稀硫酸、微热、蒸发 |
往NH4Cl溶液加入少量Na2O固体,溶液中颗粒的数目不变的是( )
| A、NH4+ |
| B、H+ |
| C、Cl- |
| D、H2O |


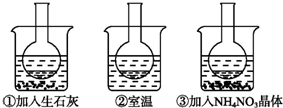 如图所示三个烧瓶中分别装入含酚酞的0.01mol?L-1 CH3COONa溶液,并分别放置在盛有水的烧杯中,然后向烧杯①中加入生石灰,烧杯②中不加任何物质,向烧杯③中加入NH4NO3晶体.
如图所示三个烧瓶中分别装入含酚酞的0.01mol?L-1 CH3COONa溶液,并分别放置在盛有水的烧杯中,然后向烧杯①中加入生石灰,烧杯②中不加任何物质,向烧杯③中加入NH4NO3晶体.