题目内容
用如图装置来制取并收集气体,你认为能制得的气体是( )


| A、用KMnO4粉末制取O2 |
| B、用浓氨水和CaO制取NH3 |
| C、用Zn和稀硫酸制取H2 |
| D、用石灰石和稀盐酸制取CO2 |
考点:实验装置综合,气体发生装置,气体的收集
专题:元素及其化合物
分析:该实验中气体发生装置选用的仪器为分液漏斗和锥形瓶,适用于固体与液体不需要加热的反应,生成的气体采用向上排空气法收集,据此分析.
解答:
解:A.用KMnO4粉末制取O2,是在加热条件下进行的,需要加热,故A错误;
B.用浓氨水和CaO制取NH3,氨气的密度小于空气的密度,则应该用向下排空气法收集,故B错误;
C.用Zn和稀硫酸制取H2,氢气的密度小于空气的密度,则应该用向下排空气法收集,故C错误;
D.用石灰石和稀盐酸制取CO2,反应常温下进行,二氧化碳的密度比空气的大,用向上排空气法收集,符合题意,故D正确.
故选D.
B.用浓氨水和CaO制取NH3,氨气的密度小于空气的密度,则应该用向下排空气法收集,故B错误;
C.用Zn和稀硫酸制取H2,氢气的密度小于空气的密度,则应该用向下排空气法收集,故C错误;
D.用石灰石和稀盐酸制取CO2,反应常温下进行,二氧化碳的密度比空气的大,用向上排空气法收集,符合题意,故D正确.
故选D.
点评:本题考查了气体制备实验的方案设计,侧重于实验原理和气体收集装置的考查,题目难度不大.

练习册系列答案
 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案
相关题目
常温,向一定体积V mL浓度均为 0.1mol?L-1 FeCl3和FeCl2溶液中滴加NaOH溶液至pH=4,溶液中有沉淀生成,过滤,得到沉淀和滤液.已知:Ksp[Fe(OH)3]=4.0×10-38,Ksp[Fe(OH)2]=8.0×10-16.下列说法正确的是( )
| A、滤液中c(Fe3+)=4.0×10-29mol?L-1 |
| B、沉淀为Fe(OH)3和Fe(OH)2的混合物 |
| C、向滤液中加入少量FeCl2溶液,一定有沉淀生成 |
| D、向滤液中继续加入NaOH溶液使pH>7时,有Fe(OH)2沉淀生成 |
下列说法不正确的是( )
| A、Ksp与温度有关 |
| B、由于Ksp(ZnS)>Ksp(CuS),所以ZnS沉淀在一定条件下可转化为CuS沉淀 |
| C、向AgCl沉淀的溶解平衡中加入NaCl固体,AgCl平衡不移动 |
| D、若在Ca(OH)2溶液与FeCl2溶液中加足量稀硝酸,无沉淀产生 |
已知Ksp(Ag2CrO4)=9.0×10-12,将等体积的4×10-3mol?L-1的AgNO3溶液和4×10-3mol?L-1的K2CrO4溶液混合,下列说法正确的是( )
| A、恰好形成Ag2CrO4饱和溶液 |
| B、能析出Ag2CrO4沉淀 |
| C、不能析出Ag2CrO4沉淀 |
| D、无法确定能否析出Ag2CrO4沉淀 |
关于中和热测定的说法错误的是( )
| A、实验需用到的主要玻璃仪器包括大、小烧杯,温度计,环形玻璃搅拌棒及泡沫塑料板、碎泡沫塑料(或硬纸板、碎纸条)等 |
| B、盐酸与某强碱中和放出的热量随反应物用量的改变而改变,但中和热不变 |
| C、NaOH稍过量的目的是保证盐酸完全被NaOH中和 |
| D、测定结果准确与否的关键是尽量减小热量损失及准确读取混合溶液的最高温度等 |
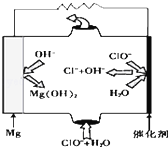 完成下列热化学方程式(化学方程式、电极反应式、表达式等)的书写:
完成下列热化学方程式(化学方程式、电极反应式、表达式等)的书写: