题目内容
生物质资源是一种污染小的可再生能源.生物质的主要转化途径及主要产物如图.
(1)下列有关生物质能的说法中正确的是 .
a.生物质能本质上来源于太阳能
b.由纤维素水解获得的产物含有丰富的生物质能
c.生物质裂解获得的汽油、柴油等属于纯净物
d.将杂草、生活垃圾等有机废弃物在沼气池中发酵产生沼气,做家庭燃气
(2)由生物质能可获得CO和H2.等物质的量的CO与H2相互反应时,其原子利用率可达100%,则该反应合成的物质可能是 .
a.汽油 b.甲醇(CH4O) c.甲醛(CH2O) d.乙酸(C2H4O2)
(3)将沼气的主要成分CH4与H2O(g)通入聚焦太阳能反应器中,可发生反应:CH4(g)+H2O(g)═CO(g)+3H2(g)△H=+206kJ?mol-1,又知CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-802kJ?mol-1,则由CO2(g)生成CO(g)的热化学方程式为 .
(4)生物质热解气(主要成分为CO、CH4、H2)可用于燃煤烟气脱硫,其主要发生的反应为:
2CO(g)+SO2(g)═S(g)+2CO2(g)△H=+8.0kJ?mol-1
2H2(g)+SO2(g)═S(g)+2H2O(g)△H=+90.4kJ?mol-1
2CO(g)+O2(g)═2CO2(g)△H=-566.0kJ?mol-1
2H2(g)+O2(g)═2H2O(g)△H=-483.6kJ?mol-1
则S(g)与O2(g)反应生成SO2(g)的热化学方程式为 .

(1)下列有关生物质能的说法中正确的是
a.生物质能本质上来源于太阳能
b.由纤维素水解获得的产物含有丰富的生物质能
c.生物质裂解获得的汽油、柴油等属于纯净物
d.将杂草、生活垃圾等有机废弃物在沼气池中发酵产生沼气,做家庭燃气
(2)由生物质能可获得CO和H2.等物质的量的CO与H2相互反应时,其原子利用率可达100%,则该反应合成的物质可能是
a.汽油 b.甲醇(CH4O) c.甲醛(CH2O) d.乙酸(C2H4O2)
(3)将沼气的主要成分CH4与H2O(g)通入聚焦太阳能反应器中,可发生反应:CH4(g)+H2O(g)═CO(g)+3H2(g)△H=+206kJ?mol-1,又知CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-802kJ?mol-1,则由CO2(g)生成CO(g)的热化学方程式为
(4)生物质热解气(主要成分为CO、CH4、H2)可用于燃煤烟气脱硫,其主要发生的反应为:
2CO(g)+SO2(g)═S(g)+2CO2(g)△H=+8.0kJ?mol-1
2H2(g)+SO2(g)═S(g)+2H2O(g)△H=+90.4kJ?mol-1
2CO(g)+O2(g)═2CO2(g)△H=-566.0kJ?mol-1
2H2(g)+O2(g)═2H2O(g)△H=-483.6kJ?mol-1
则S(g)与O2(g)反应生成SO2(g)的热化学方程式为
考点:用盖斯定律进行有关反应热的计算,混合物和纯净物,常见的能量转化形式
专题:
分析:(1)a.生物质能来源于太阳能;
b.乙醇来源于纤维素;
c.混合物是指由多种物质组成的物质;
d.沼气的主要成分是甲烷;
(2)根据质量守恒定律和化合反应的定义和特点判断,主要是利用反应前后原子的种类不变,其数目必保持不变分析判断;
(3)根据盖斯定律来分析;
(4)利用盖斯定律,适当变形,可以得出S(g)与O2(g)反应生成(g)的热化学方程式.
b.乙醇来源于纤维素;
c.混合物是指由多种物质组成的物质;
d.沼气的主要成分是甲烷;
(2)根据质量守恒定律和化合反应的定义和特点判断,主要是利用反应前后原子的种类不变,其数目必保持不变分析判断;
(3)根据盖斯定律来分析;
(4)利用盖斯定律,适当变形,可以得出S(g)与O2(g)反应生成(g)的热化学方程式.
解答:
解:(1)a.生物质本质上能来源于太阳能,故正确;
b.乙醇来源于纤维素,属于生物质能,故正确;
c.汽油、柴油等属于混合物,故错误;
d.沼气的主要成分是甲烷,故正确.
故选abd;
(2))“绿色化学”能实现零排放,即反应物中的原子利用率达到100%,也就是说反应类型一般是化合反应,且反应后产物中的各原子数目比不变,CO和H2在一定条件下按照不同的比例反应,可假定反应时的化学计量数之比为1:1,则只要各选项中的化学式能化为形式(CO)n(H2)n,都是正确的,汽油是混合物,甲醇(CH4O)可变为(CO)1(H2)2,甲醛(CH2O)可变为(CO)1(H2)1,乙酸(C2H4O2)可变为(CO)2(H2)2,故答案为:cd;
(3)已知:CH4(g)+H2O(g)═CO(g)+3H2(g)△H=+206kJ?mol-1 ①
又知:CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-802kJ?mol-1 ②
将①-②可得:CO2(g)+3H2O(g)═CO(g)+3H2(g)+2O2(g)△H=(+206kJ/mol)-(-802KJ/mol)=+1008kJ?mol-1,
故答案为:CO2(g)+3H2O(g)═CO(g)+3H2(g)+2O2(g)△H=+1008kJ?mol-1;
(4)根据以下反应①2CO(g)+SO2(g)=S(g)+2CO2(g)△H=+8.0kJ?mol-1
②2H2(g)+SO2(g)=S(g)+2H2O(g)△H=+90.4kJ?mol-1
③2CO(g)+O2(g)=2CO2(g)△H=-566.0kJ?mol-1
④2H2(g)+O2(g)=2H2O(g)△H=-483.6kJ?mol-1,
利用盖斯定律,③-①或④-②可得到S(g)与O2(g)反应生成SO2(g)的热化学方程式为S(g)+O2(g)=SO2(g)△H═-574.0kJ?mol-1,
故答案为:S(g)+O2(g)=SO2(g)△H═-574.0kJ?mol-1.
b.乙醇来源于纤维素,属于生物质能,故正确;
c.汽油、柴油等属于混合物,故错误;
d.沼气的主要成分是甲烷,故正确.
故选abd;
(2))“绿色化学”能实现零排放,即反应物中的原子利用率达到100%,也就是说反应类型一般是化合反应,且反应后产物中的各原子数目比不变,CO和H2在一定条件下按照不同的比例反应,可假定反应时的化学计量数之比为1:1,则只要各选项中的化学式能化为形式(CO)n(H2)n,都是正确的,汽油是混合物,甲醇(CH4O)可变为(CO)1(H2)2,甲醛(CH2O)可变为(CO)1(H2)1,乙酸(C2H4O2)可变为(CO)2(H2)2,故答案为:cd;
(3)已知:CH4(g)+H2O(g)═CO(g)+3H2(g)△H=+206kJ?mol-1 ①
又知:CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-802kJ?mol-1 ②
将①-②可得:CO2(g)+3H2O(g)═CO(g)+3H2(g)+2O2(g)△H=(+206kJ/mol)-(-802KJ/mol)=+1008kJ?mol-1,
故答案为:CO2(g)+3H2O(g)═CO(g)+3H2(g)+2O2(g)△H=+1008kJ?mol-1;
(4)根据以下反应①2CO(g)+SO2(g)=S(g)+2CO2(g)△H=+8.0kJ?mol-1
②2H2(g)+SO2(g)=S(g)+2H2O(g)△H=+90.4kJ?mol-1
③2CO(g)+O2(g)=2CO2(g)△H=-566.0kJ?mol-1
④2H2(g)+O2(g)=2H2O(g)△H=-483.6kJ?mol-1,
利用盖斯定律,③-①或④-②可得到S(g)与O2(g)反应生成SO2(g)的热化学方程式为S(g)+O2(g)=SO2(g)△H═-574.0kJ?mol-1,
故答案为:S(g)+O2(g)=SO2(g)△H═-574.0kJ?mol-1.
点评:本题涉及热化学和电化学知识的综合应用,应用盖斯定律求焓变,综合性强,难度中等.

练习册系列答案
相关题目
下列对图象描述正确的是( )
A、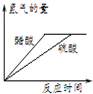 图表示体积和pH值均相同的稀硫酸和醋酸,与足量的镁反应生成H2量的关系 |
B、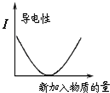 图表示向NaOH溶液中滴加稀盐酸,溶液导电性变化的关系 |
C、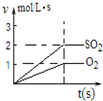 图表示2SO2(g)+O2(g)?2SO3(g)反应过程中,SO2和O2反应速率大小关系 |
D、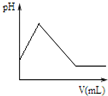 图表示向氨水中滴加稀硫酸时,溶液的pH大小变化关系 |
下列说法中正确的是( )
| A、在氧化还原反应中,一定是一种元素被氧化,另一种元素被还原 |
| B、在氧化还原反应中,不一定所有元素的化合价都发生改变 |
| C、有单质参加反应或有单质生成的反应一定是氧化还原反应 |
| D、某元素由化合态转化为游离态,这种元素一定被还原了 |
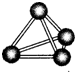 意大利罗马大学的Fulvio Cacace等人获得了极具理论研究意义的N4气体分子.N4分子结构如右图所示,下列说正确的是( )
意大利罗马大学的Fulvio Cacace等人获得了极具理论研究意义的N4气体分子.N4分子结构如右图所示,下列说正确的是( )| A、N4分子属于一种新型的化合物 |
| B、N4分子中只含有非极性键 |
| C、1 mol N4分子所含共价键数为4NA |
| D、N4沸点比P4(白磷)高 |
为了保护环境,工业上常用氨气除去废气中氮氧化物(NOx):NOx+NH3=N2+H2O(l).已知某厂每升废气中含NOx 0.0672L(只含NO和NO2),向100.000L废气中通入10.000L氨气可使NOx完全转化,测得反应后气体体积变为103.952L(气体体积均折算到标准状况).有关说法中正确的是( )
| A、每生成1.5mol N2被氧化的气体有3mol |
| B、处理过程中转移的电子数目约为1.339Na |
| C、NOx中x的数值为1.2 |
| D、出去废气中的NOx至少需要氨0.24mol |
下列离子方程式正确的是( )
| A、氯气溶于水:Cl2+H2O═2H++Cl-+ClO- |
| B、醋酸与NaHCO3溶液反应:H++HCO3-=CO2↑+H2O |
| C、将少量铜屑放入浓硝酸中的反应:Cu+4H++2NO3-=Cu2++2NO2↑+2H2O |
| D、氢氧化钡溶液与稀硫酸反应:Ba2++SO42-=BaSO4↓ |
2012年10月24日飓风“桑迪”袭击美国.一阵飓风过后,海面的巨浪上竟燃烧着熊熊大火.海水会燃烧的原因是( )
| A、飓风与海水发生剧烈摩擦,产生的巨大热能使水分子分解,引起氢气燃烧 |
| B、飓风使海水温度升高,产生高温水蒸气,达到水的着火点,使海水燃烧 |
| C、飓风产生高温,使氮气在空气中剧烈燃烧 |
| D、以上说法均有可能 |
 某化学兴趣小组在家中进行化学实验,按照图1连接好线路发现灯泡不亮,按照图2连接好线路发现灯泡亮.
某化学兴趣小组在家中进行化学实验,按照图1连接好线路发现灯泡不亮,按照图2连接好线路发现灯泡亮.