题目内容
一个12C的质量为akg,一个12CO2分子的质量为bkg,若以12CO2分子中的一个氧原子的质量为
作为相对原子质量的标准,则12CO2的相对分子质量为( )
| 1 |
| 16 |
A、
| ||
B、
| ||
C、
| ||
D、
|
考点:相对分子质量及其计算
专题:
分析:一个12C原子的质量为akg,一个12CO2分子的质量为bkg,则一个O原子的质量为
(b-a)kg,若以12CO2中的一个氧原子质量的1/16作为相对原子质量标准,12CO2的相对分子质量为一个12CO2分子的质量与一个氧原子质量的
的比值.
| 1 |
| 2 |
| 1 |
| 16 |
解答:
解:一个12C原子的质量为akg,一个12CO2分子的质量为bkg,则一个O原子的质量为
(b-a)kg,
若以12CO2中的一个氧原子质量的1/16作为相对原子质量标准,12CO2的相对分子质量为一个12CO2分子的质量与一个氧原子质量的
的比值,
12CO2的相对分子质量为=
=
.
故选B.
| 1 |
| 2 |
若以12CO2中的一个氧原子质量的1/16作为相对原子质量标准,12CO2的相对分子质量为一个12CO2分子的质量与一个氧原子质量的
| 1 |
| 16 |
12CO2的相对分子质量为=
| bkg | ||||
|
| 32b |
| b-a |
故选B.
点评:本题考查相对分子质量的计算与理解,难度不大,关键是对概念的理解.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
已知0.5LFe2(SO4)3溶液中Fe3+为1mol/L,则下列说法正确的是( )
| A、SO42-浓度为3mol/L |
| B、Fe3+的质量为28g |
| C、Fe2(SO4)3浓度为1mol/L |
| D、SO42-为0.5mol |
NA表示阿伏加德罗常数的值,下列叙述正确的是( )
| A、7.8 gNa2O2与足量的水反应,转移的电子数为0.1NA |
| B、用含有0.1molFeCl3的饱和溶液制得的氢氧化铁胶体中,胶粒数等于0.1NA |
| C、25℃时,pH=13的1LBa(OH)2溶液中含有的OH-数为0.2NA |
| D、100mL 12 mol?L-1浓盐酸与足量MnO2加热反应,产生的氯气分子数为0.3NA |
下列变化过程,属于放热反应的是( )
①铝热反应 ②酸碱中和 ③浓H2SO4稀释 ④固体氢氧化钠溶于水 ⑤H2在Cl2中燃烧 ⑥液态水变成水蒸气 ⑦NH4Cl晶体与Ba(OH)2?8H2O混合搅拌 ⑧工业制取水煤气.
①铝热反应 ②酸碱中和 ③浓H2SO4稀释 ④固体氢氧化钠溶于水 ⑤H2在Cl2中燃烧 ⑥液态水变成水蒸气 ⑦NH4Cl晶体与Ba(OH)2?8H2O混合搅拌 ⑧工业制取水煤气.
| A、①②③④⑤ | B、①②⑤ |
| C、②③④⑤ | D、①⑥⑦⑧ |
高温下丁烷裂化方式为:C4H10→CH4+C3H6;C4H10→C2H4+C2H6.一定量的丁烷裂化一段时间后,测得混合气体的平均相对分子质量为38.67.将混合气体用溴水处理后,剩余气体的平均相对分子质量可能为( )
| A、27.6 | B、29 |
| C、36.4 | D、40.5 |
已知X、Y、Z、W四种短周期元素在周期表中的相对位置如图所示,下列说法正确的是( )


| A、Z元素的原子半径可能比Y元素的小 |
| B、W的原子序数可能是Y的原子序数的2倍 |
| C、W的气态氢化物的稳定性一定比Y的强 |
| D、Z的化学活泼性一定比X强 |
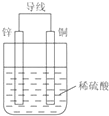 根据铜锌原电池示意图,回答下列问题:
根据铜锌原电池示意图,回答下列问题: