题目内容
下列关于溶液中离子浓度的说法正确的是( )
| A、0.1mol.L-1的NaHCO3溶液中离子浓度关系:c(Na+)=2c(CO32-)+2c(HCO3-)+2c(H2CO3) | ||||
B、室温下,将物质的量浓度相等的一元酸HA和KOH等体积混合,溶液的pH=9,则:c(OH-)=c(K+)-c(A-)=
| ||||
C、将HCN和HF溶液混合,达平衡时:c(H+)=
| ||||
| D、等物质的量的CH3COOH和CH3COONa配置成混合溶液,已知其中c(CH3COO-)>c(Na+),则c(CH3COOH)<c(CH3COO-) |
考点:离子浓度大小的比较
专题:
分析:A、根据溶液中的物料守恒来回答;
B、物质的量浓度相等的一元酸HA和KOH等体积混合,溶液的pH=9,显示碱性,则酸是弱酸,据此回答;
C、将HCN和HF溶液混合,达平衡时,氢离子浓度不具有加和性;
D、CH3COOH和CH3COONa配置成混合溶液中c(CH3COO-)>c(Na+),则氢离子浓度大于氢氧根离子,显示酸性,据此回答.
B、物质的量浓度相等的一元酸HA和KOH等体积混合,溶液的pH=9,显示碱性,则酸是弱酸,据此回答;
C、将HCN和HF溶液混合,达平衡时,氢离子浓度不具有加和性;
D、CH3COOH和CH3COONa配置成混合溶液中c(CH3COO-)>c(Na+),则氢离子浓度大于氢氧根离子,显示酸性,据此回答.
解答:
解:A、0.1mol.L-1的NaHCO3溶液中根据物料守恒得到离子浓度关系:c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3),故A错误;
B、室温下,将物质的量浓度相等的一元酸HA和KOH等体积混合,溶液的pH=9,显示碱性,则酸是弱酸,存在电荷守恒:c(OH-)+c(A-)=c(H+)-c(K+),则:c(OH-)=c(H+)-c(K+)-c(A-),故B错误;
C、将HCN和HF溶液混合,由于二者的电离程度不一样,氢离子浓度不具有加和性,所以达平衡时,氢离子浓度不能是二者氢离子浓度的平均值,故C错误;
D、等物质的量的CH3COOH和CH3COONa配置成混合溶液,已知其中c(CH3COO-)>c(Na+),c(OH-)<c(H+),显示酸性,则c(CH3COOH)<c(CH3COO-),故D正确.
故选D.
B、室温下,将物质的量浓度相等的一元酸HA和KOH等体积混合,溶液的pH=9,显示碱性,则酸是弱酸,存在电荷守恒:c(OH-)+c(A-)=c(H+)-c(K+),则:c(OH-)=c(H+)-c(K+)-c(A-),故B错误;
C、将HCN和HF溶液混合,由于二者的电离程度不一样,氢离子浓度不具有加和性,所以达平衡时,氢离子浓度不能是二者氢离子浓度的平均值,故C错误;
D、等物质的量的CH3COOH和CH3COONa配置成混合溶液,已知其中c(CH3COO-)>c(Na+),c(OH-)<c(H+),显示酸性,则c(CH3COOH)<c(CH3COO-),故D正确.
故选D.
点评:本题考查了弱电解质电离平衡,盐类水解的应用,溶液酸碱性的分析判断,溶液离子浓度大小比较等知识,题目难度中等.

练习册系列答案
相关题目
下列物质中既能跟氢氧化钠反应又能跟盐酸反应的是( )
①Al ②Al2O3 ③Al(OH)3 ④NaHCO3 ⑤NaHSO3.
①Al ②Al2O3 ③Al(OH)3 ④NaHCO3 ⑤NaHSO3.
| A、③④ | B、②③④⑤ |
| C、①③④ | D、全部 |
下列有关溶液组成的描述合理的是( )
| A、弱碱性溶液中可能大量存在Na+、K+、Cl-、HCO3- |
| B、酸性溶液中可能大量存在Na+、ClO-、SO42-、I- |
| C、常温下在c(H+)=1×10-13 mol?L-1的溶液中能大量存在Mg2+、Cu2+、SO42-、NO3- |
| D、加入铝粉能产生氢气的溶液中大量存在NH4+、Fe2+、SO42-、NO3- |
下列气体只能用排水集气法收集的是( )
| A、NO |
| B、NO2 |
| C、SO2 |
| D、NH3 |
下列说法正确的是( )
| A、用光亮洁净的铁丝蘸取某无色溶液,在无色灯焰上灼烧时观察到黄色火焰,则该溶液中一定含Na+,一定不含K+ |
| B、酸、碱中和反应的实质是H+与OH-结合生成水,故酸碱中和反应的离子反应都可用H++OH-=H2O来表示 |
| C、实验室常将硫磺撒在汞的表面,以除去不慎洒落的汞 |
| D、Na2O与Na2O2都能和水反应生成NaOH,所以它们都是碱性氧化物 |
将某些化学知识用图象表示,可以收到直观、简明的效果.下列图象所表示的化学知识中,不正确的是
( )
( )
A、 分散系的分类 |
B、 醋酸稀释 |
C、 向Na2CO3溶液中逐滴滴入盐酸 |
D、 向AlCl3溶液中滴加过量的NaOH溶液 |
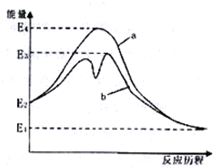 如图表示催化剂对某反应活化能的影响.几种酸的电离常数如下:HClO Kw=2.95×10-8,
如图表示催化剂对某反应活化能的影响.几种酸的电离常数如下:HClO Kw=2.95×10-8,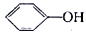 Kw=1.02×10-10H2CO3 Ka1=4.30×10-7 Ka2=5.61×10-11根据图象和数据判断,下列说法错误的是( )
Kw=1.02×10-10H2CO3 Ka1=4.30×10-7 Ka2=5.61×10-11根据图象和数据判断,下列说法错误的是( )| A、图说明了催化剂参与化学反应,并降低了活化能 |
| B、图中该反应没有催化剂参与时活化能为E2-E1 |
| C、将少量CO2通入NaClO溶液中,发生如下反应NaClO+CO2+H2O═HClO+NaHCO 3 |
D、相同浓度的NaClO溶液和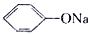 溶液,前者pH小 溶液,前者pH小 |

