题目内容
请写出关于乙醇的化学方程式:
(1)根金属钠反应 ;
(2)跟卤化氢反应 ;
(3)分子内脱水 ;
(4)分子间脱水 ;
(5)催化氧化 ;
(6)与乙酸反应 ;
(7)燃烧 .
(1)根金属钠反应
(2)跟卤化氢反应
(3)分子内脱水
(4)分子间脱水
(5)催化氧化
(6)与乙酸反应
(7)燃烧
考点:化学方程式的书写
专题:
分析:(1)根据乙醇与与金属钠反应生成乙醇钠和氢气,断开羟基上的氢氧键来书写;
(2)乙醇跟卤化氢发生取代反应生成卤乙烷和水;
(3)乙醇和浓H2SO4共热至170℃时,发生消去反应,即分子内脱水,生成乙烯;
(4)乙醇和浓H2SO4共热至140℃时,发生取代反应,即分子间脱水,生成乙醚;
(5)乙醇在铜或银催化下与O2反应生成乙醛和水;
(6)乙醇和乙酸在浓硫酸做催化剂吸水剂作用下发生酯化反应生成乙酸乙酯和水;
(7)乙醇燃烧生成二氧化碳和水;
(2)乙醇跟卤化氢发生取代反应生成卤乙烷和水;
(3)乙醇和浓H2SO4共热至170℃时,发生消去反应,即分子内脱水,生成乙烯;
(4)乙醇和浓H2SO4共热至140℃时,发生取代反应,即分子间脱水,生成乙醚;
(5)乙醇在铜或银催化下与O2反应生成乙醛和水;
(6)乙醇和乙酸在浓硫酸做催化剂吸水剂作用下发生酯化反应生成乙酸乙酯和水;
(7)乙醇燃烧生成二氧化碳和水;
解答:
解:(1)乙醇与与金属钠反应生成乙醇钠和氢气,断开羟基上的氢氧键,反应方程式为2CH3CH2OH+2Na→2CH3CH2ONa+H2↑,
故答案为:2CH3CH2OH+2Na→2CH3CH2ONa+H2↑;
(2)乙醇跟卤化氢发生取代反应,反应为:CH3CH2OH+HX
CH3CH2X+H2O,
故答案为:CH3CH2OH+HX
CH3CH2X+H2O;
(3)乙醇和浓H2SO4共热至170℃时,发生消去反应,即分子内脱水,生成乙烯,反应方程式为:CH3CH2OH
CH2═CH2↑+H2O;
故答案为:CH3CH2OH
CH2═CH2↑+H2O;
(4)乙醇和浓H2SO4共热至140℃时,发生取代反应,即分子间脱水,生成乙醚,反应方程式为:2C2H5OH
C2H5OC2H5+H2O,
故答案为:2C2H5OH
C2H5OC2H5+H2O;
(5)乙醇在铜或银催化下与O2反应生成乙醛和水,方程式为:2CH3CH2OH+O2
2CH3CHO+2H2O,
故答案为:2CH3CH2OH+O2
2CH3CHO+2H2O;
(6)乙醇和乙酸在浓硫酸做催化剂吸水剂作用下发生酯化反应生成乙酸乙酯和水,反应的化学方程式为:CH3COOH+CH3CH2OH CH3COOCH2CH3+H2O,
CH3COOCH2CH3+H2O,
故答案为:CH3COOH+CH3CH2OH CH3COOCH2CH3+H2O;
CH3COOCH2CH3+H2O;
(7)乙醇燃烧生成二氧化碳和水,反应的化学方程式为:C2H5OH+3O2
2CO2+3H2O,
故答案为:C2H5OH+3O2
2CO2+3H2O;
故答案为:2CH3CH2OH+2Na→2CH3CH2ONa+H2↑;
(2)乙醇跟卤化氢发生取代反应,反应为:CH3CH2OH+HX
| △ |
故答案为:CH3CH2OH+HX
| △ |
(3)乙醇和浓H2SO4共热至170℃时,发生消去反应,即分子内脱水,生成乙烯,反应方程式为:CH3CH2OH
| 浓硫酸 |
| 170℃ |
故答案为:CH3CH2OH
| 浓硫酸 |
| 170℃ |
(4)乙醇和浓H2SO4共热至140℃时,发生取代反应,即分子间脱水,生成乙醚,反应方程式为:2C2H5OH
| 浓硫酸 |
| 140℃ |
故答案为:2C2H5OH
| 浓硫酸 |
| 140℃ |
(5)乙醇在铜或银催化下与O2反应生成乙醛和水,方程式为:2CH3CH2OH+O2
| 铜或银 |
| △ |
故答案为:2CH3CH2OH+O2
| 铜或银 |
| △ |
(6)乙醇和乙酸在浓硫酸做催化剂吸水剂作用下发生酯化反应生成乙酸乙酯和水,反应的化学方程式为:CH3COOH+CH3CH2OH
 CH3COOCH2CH3+H2O,
CH3COOCH2CH3+H2O,故答案为:CH3COOH+CH3CH2OH
 CH3COOCH2CH3+H2O;
CH3COOCH2CH3+H2O;(7)乙醇燃烧生成二氧化碳和水,反应的化学方程式为:C2H5OH+3O2
| 点燃 |
故答案为:C2H5OH+3O2
| 点燃 |
点评:本题主要考查了乙醇的化学性质,掌握反应的机理是解题的关键,题目难度不大.

练习册系列答案
相关题目
下列过程或现象与盐类水解无关的是( )
| A、可用碳酸钠与醋酸制取少量二氧化碳 |
| B、NaHCO2与Al2(SO4)3混合泡沫灭火剂 |
| C、配制氯化铁溶液时加入少量的盐酸 |
| D、实验室用饱和的FeCl3溶液制取氢氧化铁胶体 |
几种化合物的溶解度随温度变化曲线如图所示,下列说法正确的是( )


| A、NaClO3的溶解是放热过程 |
| B、由图中数据可求出300K时MgCl2 饱和溶液的物质的量浓度 |
| C、可采用复分解反应制备Mg(ClO3)2:MgCl2+2NaClO3═Mg(ClO3)2+2NaCl |
| D、若NaCl中含有少量Mg(ClO3)2,可用降温结晶方法提纯 |
甲、乙是由同主族元素R、Z组成的两种单质,常温下能进行如下反应:甲+乙+H2O--HRO3+HZ(未配平).下列说法正确的是( )
| A、R原子最外层电子数为5 |
| B、单质的氧化性:甲>乙 |
| C、原子半径:R>Z |
| D、HRO3与HZ的计量数比为5:1 |
下列说法中不正确的是( )
| A、8NH3(g)+6NO2(g)═7N2(g)+12H2O(g)△H<0,则该反应能自发进行 |
| B、pH相等的四种溶液:a.CH3COONa b.Na2CO3 c.NaHCO3d.NaOH,则四种溶液中溶质的物质的量浓度由小到大顺序为:d<b<c<a |
| C、pH=2的一元酸和pH=12的二元强碱等体积混合:c(OH-)≤c(H+) |
| D、pH=9的CH3COONa溶液和pH=9的NH3?H2O溶液中水的电离程度相同 |
下列说法正确的是( )
| A、过滤时,滤纸的边缘要高于漏斗的边缘,防止液体从滤纸和漏斗壁之间流下 |
| B、所有使用到胶头滴管的操作中,胶头滴管必须垂直悬空,离仪器口1-2cm |
| C、氢氧化钠浓溶液溅入眼中,应立即用大量水冲洗 |
| D、可用磨口玻璃塞保存NaOH、Na2CO3等碱性溶液,棕色瓶保存浓硝酸 |
化学与能源开发、环境保护、生产生活等密切相关.下列叙述错误的是( )
| A、光催化水制氢比电解水制氢更节能环保 |
| B、用聚乙烯塑料代替聚乳酸塑料可减少白色污染 |
| C、开发利用可再生能源,可减少化石燃料的使用 |
| D、改进汽车尾气净化技术,可减少大气污染物的排放 |

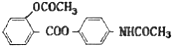 ,其合成途径如下:
,其合成途径如下: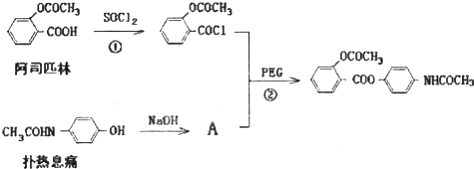 完成下列填空:
完成下列填空: