题目内容
化学肥料在农业生产中具有重要的作用,关系着农业生产是否丰收.化学肥料在农业生产中的广泛应用,为化学肥料的大规模工业生产提供了舞台.
(1)在合成氨的设备(合成塔)中,设置热交换器的目的是 .
(2)生产硝酸的过程中常会产生一些氮的氧化物,一般可采用下列两种方法处理.
碱液吸收法:NO+NO2+2NaOH═2NaNO2+H2O 氨还原法:8NH3+6NO2
7N2+12H2O(NO也有类似的反应)
请从绿色化学的角度分析两种方法的优劣: .
(3)某化肥厂用NH3制备NH4NO3.已知:由NH3制NO的产率是96%,NO制HNO3的产率是92%,则制HNO3所用去的NH3的质量占总耗用NH3质量(不考虑其他损耗)的 %.
(4)硝酸铵是一种常用的氮肥,在贮存和使用该化肥时,把应注意的事项及理由填入下表(填两条应注意的事项及理由即可).
(1)在合成氨的设备(合成塔)中,设置热交换器的目的是
(2)生产硝酸的过程中常会产生一些氮的氧化物,一般可采用下列两种方法处理.
碱液吸收法:NO+NO2+2NaOH═2NaNO2+H2O 氨还原法:8NH3+6NO2
| ||
| △ |
请从绿色化学的角度分析两种方法的优劣:
(3)某化肥厂用NH3制备NH4NO3.已知:由NH3制NO的产率是96%,NO制HNO3的产率是92%,则制HNO3所用去的NH3的质量占总耗用NH3质量(不考虑其他损耗)的
(4)硝酸铵是一种常用的氮肥,在贮存和使用该化肥时,把应注意的事项及理由填入下表(填两条应注意的事项及理由即可).
| 注意事项 | 理由 | |
| ① | ||
| ② |
考点:工业合成氨,工业制取硝酸,化学方程式的有关计算
专题:元素及其化合物,化学应用
分析:(1)在合成氨的设备(合成塔)中,设置热交换器的目的是,把不同温度之间的气体进行热交换,可预热反应气体,可起到充分利用能源的目的;
(2)依据反应化学方程式反应物和生成物的性质和经济效益分析,绿色化学为无污染,原子利用率高的生产;
(3)根据NH3制NO的产率是96%、NO制HNO3的产率是92%,利用氮原子守恒来计算硝酸的量,再由HNO3跟NH3反应生成NH4NO3来计算氨气的量,最后计算制HNO3所用去的NH3的质量占总耗NH3质量的百分数;
(4)硝酸铵受撞击时易分解产生气体,在有限空间内,气体急速膨胀,易爆炸.
(2)依据反应化学方程式反应物和生成物的性质和经济效益分析,绿色化学为无污染,原子利用率高的生产;
(3)根据NH3制NO的产率是96%、NO制HNO3的产率是92%,利用氮原子守恒来计算硝酸的量,再由HNO3跟NH3反应生成NH4NO3来计算氨气的量,最后计算制HNO3所用去的NH3的质量占总耗NH3质量的百分数;
(4)硝酸铵受撞击时易分解产生气体,在有限空间内,气体急速膨胀,易爆炸.
解答:
解:(1)化氧化设备中设置热交换器,把不同温度之间的气体进行热交换,可预热反应气体,余热利用可起到充分利用能源的目的;故答案为:利用余热,节约能源;(2)碱液吸收法:NO+NO2+2NaOH═2NaNO2+H2O,NH3还原法:8NH3+6NO2
7N2+12H2O,分析可知碱液吸收法消耗大量的氢氧化钠生成的亚硝酸盐有毒,NH3还原法产物无污染,得到合成氨的原料气;
故答案为:碱液吸收法要消耗大量的NaOH,同时产生有毒的NaNO2;NH3还原法不消耗贵重原料,且产物无污染,N2又可做合成NH3的原料气;
(3)由NH3制NO的产率是96%、NO制HNO3的产率是92%,
根据氮原子守恒可知,
NH3~NO~HNO3,
则1mol氨气可得到硝酸1mol×96%×92%=0.8832mol,
由HNO3+NH3═NH4NO3,
则该反应消耗的氨气的物质的量为0.8832mol,
氨气的质量之比等于物质的量之比,
则制HNO3所用去的NH3的质量占总耗NH3质量的百分数为
×100%=53.1%;
故答案为:53.1;
(4)由于硝酸铵受撞击时易爆炸,因此硝酸铵不能与易燃物混放;不能用铁锤等物将结块的硝酸铵砸碎;不能受到严重撞击;铵盐水解显酸性不能和水解显碱性的草木灰混合使用,硝酸铵是易溶于水的物质易在土壤中流失;
①不能与碱性肥料混施 硝酸铵溶液呈碱性;②不能剧烈撞击 硝酸铵易爆炸;
故答案为:①不能与碱性肥料混施 硝酸铵溶液呈碱性;②不能剧烈撞击 硝酸铵易爆炸.
| ||
| △ |
故答案为:碱液吸收法要消耗大量的NaOH,同时产生有毒的NaNO2;NH3还原法不消耗贵重原料,且产物无污染,N2又可做合成NH3的原料气;
(3)由NH3制NO的产率是96%、NO制HNO3的产率是92%,
根据氮原子守恒可知,
NH3~NO~HNO3,
则1mol氨气可得到硝酸1mol×96%×92%=0.8832mol,
由HNO3+NH3═NH4NO3,
则该反应消耗的氨气的物质的量为0.8832mol,
氨气的质量之比等于物质的量之比,
则制HNO3所用去的NH3的质量占总耗NH3质量的百分数为
| 1mol |
| 1mol+0.8832mol |
故答案为:53.1;
(4)由于硝酸铵受撞击时易爆炸,因此硝酸铵不能与易燃物混放;不能用铁锤等物将结块的硝酸铵砸碎;不能受到严重撞击;铵盐水解显酸性不能和水解显碱性的草木灰混合使用,硝酸铵是易溶于水的物质易在土壤中流失;
①不能与碱性肥料混施 硝酸铵溶液呈碱性;②不能剧烈撞击 硝酸铵易爆炸;
故答案为:①不能与碱性肥料混施 硝酸铵溶液呈碱性;②不能剧烈撞击 硝酸铵易爆炸.
点评:本题考查了工业制备原理应用,实验制备物质的分析判断,利用物质的转化及质量守恒的方法来进行简单计算,使用硝酸铵的注意事项,明确转化中的化学反应得出物质之间的关系是解答的关键.

练习册系列答案
 备战中考寒假系列答案
备战中考寒假系列答案
相关题目
食盐、蔗糖、醋酸、“84消毒液”、明矾等是灾后居民日常生活中经常使用的物质,下列有关说法或表示正确的是( )
A、食盐中阴离子的结构示意图为: |
| B、蔗糖和醋酸都是弱电解质 |
C、“84消毒液”中有效成分NaClO的电子式为: |
| D、明矾溶液水解可制得Al(OH)3胶体,用于杀菌消毒 |
化学是一门中心学科,与社会、生活、科研密切的关系.下列叙述中正确的是( )
| A、将表面有铜绿[Cu2(OH)2CO3]的铜器放入硝酸中浸泡,除去铜绿 |
| B、大量使用煤发电是形成雾霾的主要原因,天然气、煤气大量泄露遇到明火会爆炸 |
| C、利用化学反应可实现12C到14C的转化,高炉炼铁是炼铁最常用的方法 |
| D、青铜(铜锡合金)是一种复合材料,二氧化硅可以做光导纤维 |
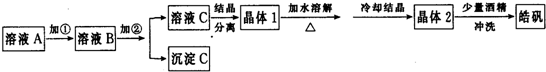
 已知海水电解制得的氢气用于合成氨,某合成氨厂生产流程如图:
已知海水电解制得的氢气用于合成氨,某合成氨厂生产流程如图: 
 反应②的化学方程式是
反应②的化学方程式是
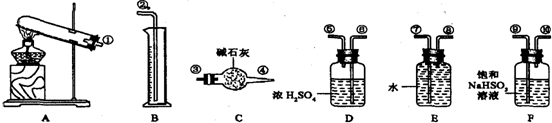
 如图为实验室制取蒸馏水的装置示意图,根据图示回答下列问题
如图为实验室制取蒸馏水的装置示意图,根据图示回答下列问题