题目内容
 硫酸用途十分广泛,工业上合成硫酸时,将SO2转化为催化氧化是一个关键步骤.请回答下列问题:
硫酸用途十分广泛,工业上合成硫酸时,将SO2转化为催化氧化是一个关键步骤.请回答下列问题:(1)该反应在恒温恒容密闭容器中进行,判断其达到平衡状态的标志是
a.SO2和SO3浓度相等 b.SO2百分含量保持不变
c.容器中气体的压强不变 d.SO3的生成速率与SO2的消耗速率相等
e.容器中混合气体的密度保持不变
(2)某温度下,2SO2(g)+O2(g)
| 催化剂 |
| △ |
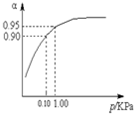
(3)一定温度时,SO2的平衡转化率(α)与体系总压强(p)的关系如图所示.试分析工业生产中采用常压的原因是
(4)将一定量的SO2和0.7mol O2放入一定体积的密闭容器中,在550℃和催化剂作用下发生反应.反应达到平衡后,将容器中的混合气体通过过量NaOH溶液,气体体积减少了21.28L;再将剩余气体通过焦性没食子酸的碱性溶液吸收O2,气体的体积又减少了5.6L(以上气体体积均为标准状况下的体积).则该反应达到平衡时SO2的转化率是多少?(要写出计算过程,计算结果保留一位小数.)
考点:化学平衡状态的判断,反应速率的定量表示方法,化学平衡的影响因素,化学平衡的计算
专题:化学平衡专题
分析:(1)化学反应达到化学平衡状态时,正逆反应速率相等,且不等于0,各物质的浓度不再发生变化,由此衍生的一些物理量不发生变化,以此进行判断,得出正确结论;(2)根据v=
进行计算;
(3)根据图象进行结合经济效益进行分析;
(4))混合气体通过过量NaOH溶液时,减少的气体是二氧化硫和三氧化硫,根据剩余氧气的量计算参加反应的氧气的量,根据参加反应的氧气的量计算参加反应的二氧化硫、三氧化硫的量,二氧化硫和三氧化硫混合气体体积减去三氧化硫的量就是未参加反应的二氧化硫的量,再根据转化率公式计算.
| ||
| t |
(3)根据图象进行结合经济效益进行分析;
(4))混合气体通过过量NaOH溶液时,减少的气体是二氧化硫和三氧化硫,根据剩余氧气的量计算参加反应的氧气的量,根据参加反应的氧气的量计算参加反应的二氧化硫、三氧化硫的量,二氧化硫和三氧化硫混合气体体积减去三氧化硫的量就是未参加反应的二氧化硫的量,再根据转化率公式计算.
解答:
解:(1)2SO2(g)+O2(g)
2SO3(g),
a.平衡时各物质的浓度大小关系取决于物质的起始物质的量和转化率,故SO2和SO3浓度相等不能作为判断是否达到平衡状态的依据,故a错误;
b.SO2百分含量保持不变,说明二氧化硫的浓度不变,故可作为判断是否达到平衡状态的依据,故b准确;
c.应前后气体的体积不等,故容器中气体的压强不变可作为判断是否达到化学平衡状态的依据,故C正确;
d.SO3的生成速率是正反应速率,SO2的消耗速率也是正反应速率,故不能作为判断是否达到平衡状态的依据,故d错误,
故答案为:bc;
(2)△n(O2)=△n(SO3)=0.5×0.18=0.09mol,v(O2)=
=
=0.036mol?L-1?min-1,
Q=196kJ?mol-1×0.09mol=17.64kJ,
故答案为:0.036;17.64;
(3)由图可知:在常压下该反应转化率已达95%,若再加压,转化率提高很少,但对设备要求高,同时要消耗大量的能源,不经济,
故答案为:在常压下该反应转化率已很高,若再加压,对设备要求高,同时要消耗大量的能源,不经济;
(4)混合气体通过过量NaOH溶液时,减少的气体是二氧化硫和三氧化硫,所以三氧化硫和未参加反应的二氧化硫的体积是21.28L,剩余氧气的体积是5.6L,则参加反应的氧气的体积=0.7mol×22.4L/mol-5.6L=10.08L,根据二氧化硫、三氧化硫和氧气的关系式知,参加氧化还原反应的二氧化硫的体积=10.08L×2=20.16L,生成三氧化硫的体积=10.08L×2=20.16L,则未参加氧化还原反应的二氧化硫的体积=21.28L-20.16L=1.12L,原来二氧化硫的体积=20.16L+1.12L=21.28L,所以二氧化硫的转化率=
×100%=94.7%,
答:该反应达到平衡时SO2的转化率是94.7%.
| 催化剂 |
| △ |
a.平衡时各物质的浓度大小关系取决于物质的起始物质的量和转化率,故SO2和SO3浓度相等不能作为判断是否达到平衡状态的依据,故a错误;
b.SO2百分含量保持不变,说明二氧化硫的浓度不变,故可作为判断是否达到平衡状态的依据,故b准确;
c.应前后气体的体积不等,故容器中气体的压强不变可作为判断是否达到化学平衡状态的依据,故C正确;
d.SO3的生成速率是正反应速率,SO2的消耗速率也是正反应速率,故不能作为判断是否达到平衡状态的依据,故d错误,
故答案为:bc;
(2)△n(O2)=△n(SO3)=0.5×0.18=0.09mol,v(O2)=
| ||
| t |
| ||
| 0.5 |
Q=196kJ?mol-1×0.09mol=17.64kJ,
故答案为:0.036;17.64;
(3)由图可知:在常压下该反应转化率已达95%,若再加压,转化率提高很少,但对设备要求高,同时要消耗大量的能源,不经济,
故答案为:在常压下该反应转化率已很高,若再加压,对设备要求高,同时要消耗大量的能源,不经济;
(4)混合气体通过过量NaOH溶液时,减少的气体是二氧化硫和三氧化硫,所以三氧化硫和未参加反应的二氧化硫的体积是21.28L,剩余氧气的体积是5.6L,则参加反应的氧气的体积=0.7mol×22.4L/mol-5.6L=10.08L,根据二氧化硫、三氧化硫和氧气的关系式知,参加氧化还原反应的二氧化硫的体积=10.08L×2=20.16L,生成三氧化硫的体积=10.08L×2=20.16L,则未参加氧化还原反应的二氧化硫的体积=21.28L-20.16L=1.12L,原来二氧化硫的体积=20.16L+1.12L=21.28L,所以二氧化硫的转化率=
| 20.16L |
| 21.28L |
答:该反应达到平衡时SO2的转化率是94.7%.
点评:本题考查平衡状态的判断、影响化学平衡的因素、转化率的计算等知识点,难度中等.

练习册系列答案
相关题目
关于如图化学反应中的热效应,下列说法不正确的是( )


| A、图Ⅰ表示:反应物的总能量高于生成物的总能量,则反应放热,△H<0 |
| B、图Ⅱ表示:反应物的总能量低于生成物的总能量,则反应吸热,△H>0 |
| C、H2与O2化合生成液态水的能量变化过程可用图Ⅰ来表现 |
| D、符合图Ⅱ所示能量变化的化学反应,必须要加热才能发生 |
四种元素的离子:aXm+、bYn+、cZn-、dRm-(a、b、c、d为元素的原子序数),它们具有相同的电子层结构,若m>n,对下列叙述的判断正确的是( )
| A、元素的原子序数:a>b>c>d |
| B、a-b=n-m |
| C、元素的非金属性:R>Z |
| D、最高价氧化物对应的水化物的碱性:X>Y |
取三张蓝色石蕊试纸放在玻璃片上,然后按顺序滴加69%的硝酸,98.3%的硫酸和新制氯水,三张试纸最后颜色是( )
| A、白,红,白 |
| B、红,黑,红 |
| C、红,红,红 |
| D、白,黑,白 |
 A、B、C、D、E是中学常见的单质,X是化合物.A、B均为常见的金属,且在地壳中的含量分别为金属元素的前两位;常温下C是气态非金属单质,可以燃烧;D是空气主要成份之一,可与C发生重要工业反应生成X;E是固体非金属单质,在氧气中燃烧时有明亮的蓝紫色火焰.根据上述物质的信息,回答下列有关问题:
A、B、C、D、E是中学常见的单质,X是化合物.A、B均为常见的金属,且在地壳中的含量分别为金属元素的前两位;常温下C是气态非金属单质,可以燃烧;D是空气主要成份之一,可与C发生重要工业反应生成X;E是固体非金属单质,在氧气中燃烧时有明亮的蓝紫色火焰.根据上述物质的信息,回答下列有关问题:
 ,分子式:
,分子式: )在催化剂作用下生成聚苯丙烯的反应方程式:
)在催化剂作用下生成聚苯丙烯的反应方程式: 与Br2以物质的量之比为1:1反应,所得产物有
与Br2以物质的量之比为1:1反应,所得产物有 一种Al-Fe合金的立体晶胞如图所示.请据此回答下列问题:
一种Al-Fe合金的立体晶胞如图所示.请据此回答下列问题: