题目内容
17.金属钠着火后,可用来灭火的是( )| A. | 水 | B. | 煤油 | C. | 沙子 | D. | 泡沫灭火器 |
分析 钠着火生成过氧化钠,可与二氧化碳或水反应生成氧气,且钠与水反应生成氢气,以此解答该题.
解答 解:A.钠着火生成过氧化钠,与二氧化碳、水都反应生成氧气,从而促进钠燃烧,所以不能用水灭火,故A错误;
B.煤油是可燃物,加入煤油,燃烧更旺盛,故B错误;
C.加入沙土可掩盖钠,隔绝空气,可起到灭火的作用,故C正确;
D.钠着火生成过氧化钠,与二氧化碳、水都反应生成氧气,从而促进钠燃烧,所以不能用二氧化碳灭火,故D错误;
故选C.
点评 本题考查钠的性质,题目难度不大,注意根据钠的性质以及燃烧产物判断灭火的方法.

练习册系列答案
相关题目
7.工业上为了处理含有Cr2O${\;}_{7}^{2-}$的酸性工业废水,采用下面的处理方法:往工业废水中加入适量NaCl,以铁为电极进行电解,经过一段时间,有Cr(OH)3和Fe(OH)3沉淀生成,工业废水中铬元素的含量已低于排放标准.关于上述方法,下列说法错误的是( )
| A. | 阳极反应:Fe-2e-═Fe2+ | |
| B. | 阴极反应:2H++2e-═H2↑ | |
| C. | 在电解过程中工业废水由酸性变为碱性 | |
| D. | 可以将铁电极改为石墨电极 |
8.核潜艇上的核反应堆使用液态铝钠合金(单质钠和单质铝熔合而成)作载热介质,下列有关说法中正确的是( )
| A. | 该合金的熔点介于钠、铝之间 | |
| B. | 钠或铝形成的氧化物均为碱性氧化物 | |
| C. | 等质量钠和铝分别与足量的盐酸反应钠产生的气体多 | |
| D. | 若合金中n(Na)=n(Al),将其投入到足量的水中,可得无色透明溶液 |
5.某无色溶液中加入BaCl2溶液,生成不溶于稀硝酸的白色沉淀,则溶液中存在的离子可能是( )
| A. | 一定含有CO32- | B. | 一定含有Ag+ | ||
| C. | 一定含有SO42- | D. | 可能含有SO42-也可能含有Ag+ |
12.向盛有100mLNH4Al(SO4)2溶液的烧杯中滴加NaOH溶液,沉淀物质的量随NaOH溶液体积变化示意图如下:
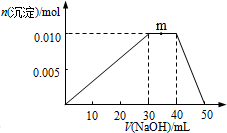
下列说法正确的是( )

下列说法正确的是( )
| A. | NH4Al(SO4)2的电离方程式为:NH4Al(SO4)2?NH4++Al3++2SO42- | |
| B. | m点反应的离子方程式:NH4++OH-═NH3•H2O | |
| C. | 反应过程中SO42-的浓度始终保持不变 | |
| D. | 由图象可知所滴NaOH溶液的浓度为0.1mol•L-1 |
9.下列说法正确的是( )
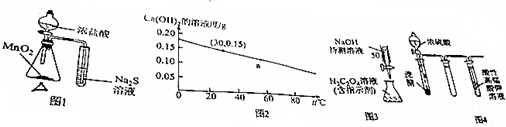

| A. | 图1的装置可用于比较MnO2、Cl2、S的氧化性 | |
| B. | 图2可知:30℃时Ca(OH)2溶液的浓度一定大于60℃时的温度 | |
| C. | 图3的装置可用于已知浓度的H2C2O4溶液测定未知浓度的NaOH溶液 | |
| D. | 图4的实验现象:酸性高锰酸钾溶液中有气泡出现,且溶液颜色逐渐变浅乃至褪去 |
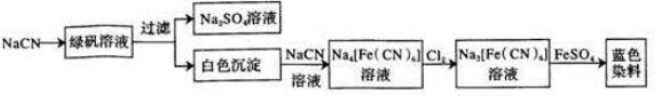
6.碳酸锂(相对分子质量74)广泛应用于化工、冶金、陶瓷、医药、制冷、焊接、锂合金等行业.制备流程如下:

已知:碳酸锂的溶解度为(g/L)
(1)锂辉石(Li2Al2Si4Ox)可以用氧化物的形式表示其组成,形式为Li2O•Al2O3•4SiO2
(2)硫酸化焙烧工业反应温度控制在250~300℃,主要原因是防止浓硫酸蒸发;同时,硫酸用量为理论耗酸量的115%左右,硫酸如果加入过多则C(填入选项代号).
A.增加酸消耗量 B.增加后续杂质的处理量 C.增加后续中和酸的负担
(3)水浸时,需要在搅拌下加入石灰石粉末的主要作用是中和过量的浓硫酸
(4)“沉锂”的化学方程式为Li2SO4+Na2CO3=Li2CO3↓+Na2SO4
(5)“沉锂”需要在95℃以上进行,主要原因是Li2CO3的溶解度小,得到的Li2CO3多.

已知:碳酸锂的溶解度为(g/L)
| 温度/℃ | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 80 | 100 |
| Li2CO3 | 1.54 | 1.43 | 1.33 | 1.25 | 1.17 | 1.08 | 1.01 | 0.85 | 0.72 |
(2)硫酸化焙烧工业反应温度控制在250~300℃,主要原因是防止浓硫酸蒸发;同时,硫酸用量为理论耗酸量的115%左右,硫酸如果加入过多则C(填入选项代号).
A.增加酸消耗量 B.增加后续杂质的处理量 C.增加后续中和酸的负担
(3)水浸时,需要在搅拌下加入石灰石粉末的主要作用是中和过量的浓硫酸
(4)“沉锂”的化学方程式为Li2SO4+Na2CO3=Li2CO3↓+Na2SO4
(5)“沉锂”需要在95℃以上进行,主要原因是Li2CO3的溶解度小,得到的Li2CO3多.
11.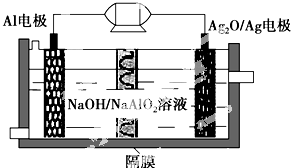 Al-Ag2O电池是一种可用作水下动力的优良电源,其原理如图所示.该电池工作时总反应式为2Al+3Ag2O+2NaOH═2NaAlO2+6Ag+H2O,则下列说法错误的是( )
Al-Ag2O电池是一种可用作水下动力的优良电源,其原理如图所示.该电池工作时总反应式为2Al+3Ag2O+2NaOH═2NaAlO2+6Ag+H2O,则下列说法错误的是( )
 Al-Ag2O电池是一种可用作水下动力的优良电源,其原理如图所示.该电池工作时总反应式为2Al+3Ag2O+2NaOH═2NaAlO2+6Ag+H2O,则下列说法错误的是( )
Al-Ag2O电池是一种可用作水下动力的优良电源,其原理如图所示.该电池工作时总反应式为2Al+3Ag2O+2NaOH═2NaAlO2+6Ag+H2O,则下列说法错误的是( )| A. | 工作时正极发生还原反应 | |
| B. | 当电极上生成1.08 g Ag时,电路中转移的电子为0.01 mol | |
| C. | Al电极的反应式为Al-3e-+4OH-=AlO2-+2H2O | |
| D. | 工作时电解液中的Na+透过隔膜移向Al电极放电充电 |

 .
. 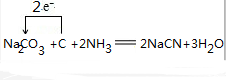 .
.