题目内容
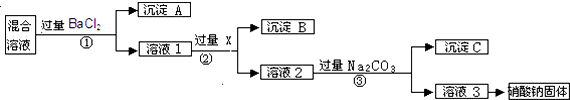
5.某无色溶液中加入BaCl2溶液,生成不溶于稀硝酸的白色沉淀,则溶液中存在的离子可能是( )| A. | 一定含有CO32- | B. | 一定含有Ag+ | ||
| C. | 一定含有SO42- | D. | 可能含有SO42-也可能含有Ag+ |
分析 在无色透明的未知溶液中加入BaCl2溶液生成不溶于稀硝酸的白色沉淀,该沉淀可能是氯化银或硫酸钡,以此解答该题.
解答 解:向某溶液中加入BaCl2溶液,生成不溶于稀HNO3的白色沉淀,白色沉淀可能是硫酸钡或氯化银,则未知溶液中可能大量存在硫酸根离子、银离子中的至少一种离子.
故选D.
点评 本题考查离子的共存及离子的检验,为高频考点,把握白色沉淀为氯化银或硫酸钡为解答的关键,注意硫酸银不溶于水,银离子与硫酸根离子不能共存,题目难度不大.

练习册系列答案
 举一反三单元同步过关卷系列答案
举一反三单元同步过关卷系列答案
相关题目
15.已知下列数据:
Fe(s)+$\frac{1}{2}$O2(g)═FeO(s)△H=-272kJ•mol-1
2Al(s)+$\frac{3}{2}$O2(g)═Al2O3(s)△H=-1675kJ•mol-1
则2Al(s)+3FeO(s)═Al2O3(s)+3Fe(s)的△H是( )
Fe(s)+$\frac{1}{2}$O2(g)═FeO(s)△H=-272kJ•mol-1
2Al(s)+$\frac{3}{2}$O2(g)═Al2O3(s)△H=-1675kJ•mol-1
则2Al(s)+3FeO(s)═Al2O3(s)+3Fe(s)的△H是( )
| A. | +859 kJ•mol-1 | B. | -859 kJ•mol-1 | C. | -1403 kJ•mol-1 | D. | -2491 kJ•mol-1 |
16.以葡萄糖为燃料的微生物燃料电池结构示意图如图所示.关于该电池的叙述不正确的是( )
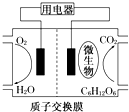

| A. | 该电池不能够在高温下工作 | |
| B. | 电池的负极反应:C6H12O6+6H2O-24e-═6CO2↑+24H+ | |
| C. | 放电过程中,H+会从负极区向正极区迁移 | |
| D. | 在电池反应中,每消耗1mol氧气,理论上能生成标准状况下CO2气体$\frac{22.4}{6}$ L |
13.常温下,往H2O2溶液中滴加少量FeSO4溶液,可反生如下两个反应:2Fe2++H2O2+2H+═2Fe3++2H2O;2Fe3++H2O2═2Fe2++O2+2H+下列说法正确的是( )
| A. | H2O2的氧化性比Fe3+强,其还原性比Fe2+强 | |
| B. | 在该实验中,最终溶液仍为无色 | |
| C. | 在该实验中,Fe2+和Fe3+总量保持不变 | |
| D. | H2O2值能的电子,不能失电子 |
20.下列叙述正确的是( )
| A. | 1molCO2的质量为44g/mol | |
| B. | CO2的摩尔质量为44g | |
| C. | CO2的摩尔质量等于CO2的相对分子质量 | |
| D. | NA个CO2的质量与CO2的相对分子质量在数值上相同(NA为阿伏加德罗常数) |
17.金属钠着火后,可用来灭火的是( )
| A. | 水 | B. | 煤油 | C. | 沙子 | D. | 泡沫灭火器 |
14.向一定浓度的Na2Si03溶液里通入过量CO2气体,发生化学反应,得到无色、透明的液体,该液体能发生丁达尔效应.下列叙述正确的是( )
| A. | 发生的化学反应是复分解反应 | |
| B. | 反应的生成物中有Na2CO3 | |
| C. | 反应后形成的混合物的聚集颗粒直径为1~100nm | |
| D. | 反应说明硅酸易溶于水 |
19.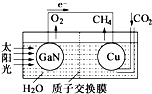 人工光合作用能够借助太阳能,用CO2和H2O制备化学原料.科学家用氮化镓材料与铜组装如图的人工光合系统,成功地实现了以CO2和H2O合成CH4,下列说法不正确的是( )
人工光合作用能够借助太阳能,用CO2和H2O制备化学原料.科学家用氮化镓材料与铜组装如图的人工光合系统,成功地实现了以CO2和H2O合成CH4,下列说法不正确的是( )
 人工光合作用能够借助太阳能,用CO2和H2O制备化学原料.科学家用氮化镓材料与铜组装如图的人工光合系统,成功地实现了以CO2和H2O合成CH4,下列说法不正确的是( )
人工光合作用能够借助太阳能,用CO2和H2O制备化学原料.科学家用氮化镓材料与铜组装如图的人工光合系统,成功地实现了以CO2和H2O合成CH4,下列说法不正确的是( )| A. | 该过程是将太阳能转化为化学能的过程 | |
| B. | GaN表面发生氧化反应,有O2产生 | |
| C. | 电解液中的H+从质子交换膜右侧向左侧迁移 | |
| D. | Cu表面的电极反应式 CO2+8e-+8H+═CH4+2H2O |