题目内容
13.下列物质的分子中,键角最小的是( )| A. | NH3 | B. | SO3 | C. | H2O | D. | CCl4 |
分析 根据VSEPR理论和杂化轨道理论判断分子的理论构型,再考虑故孤电子对斥力对键角的影响解答.
解答 解:A.NH3中N原子是sp3杂化,sp3杂化的理论键角为109°28′,由于NH3分子存在一对孤电子对占据正四面体的一个顶角,孤电子对的斥力大于成键的斥力,导致NH3分子的键角<109°28′;
B.SO3中S原子是sp2杂化,分子为平面正三角形构型,键角为120°;
C.H2O中O原子是sp3杂化,sp3杂化的理论键角为109°28′,由于H2O中存在两对孤电子对,孤电子对占据正四面体的两个顶角,且孤电子对斥力大于成键的斥力,导致H2O分子的键角<109°28′,且比NH3分子的键角还要小;
D.CCl4中C原子是sp3杂化,sp3杂化的理论键角为109°28′,则CCl4的键角为109°28′.
综上,键角最小的应为H2O,
故选C.
点评 本题考察价层电子对互斥理论和杂化轨道理论判断粒子的空间构型,以及孤电子对的存在对键角的影响,需要记住斥力顺序为:孤电子对与孤电子对>孤电子对与成键电子>成键电子与成键电子.本题难度不大,是基础题.

练习册系列答案
相关题目
2.“民以食为天,食以安为先”.下列说法合理的是( )
| A. | 用二氧化硫熏蒸馒头给馒头增白 | |
| B. | 用甲醛溶液浸泡海鲜以延长保鲜时间 | |
| C. | 肉制品中可以添加过量亚硝酸钠,用于改良色泽与口感 | |
| D. | 苯甲酸钠用于食品添加剂时,必须严格按相关标准添加 |
1. pH=2的HA、HB两种酸溶液各1mL,分别加水稀释到1000mL,其pH与溶液体积V的关系如图所示,其中A代表酸HA,B代表酸HB.下列说法正确的是( )
pH=2的HA、HB两种酸溶液各1mL,分别加水稀释到1000mL,其pH与溶液体积V的关系如图所示,其中A代表酸HA,B代表酸HB.下列说法正确的是( )
 pH=2的HA、HB两种酸溶液各1mL,分别加水稀释到1000mL,其pH与溶液体积V的关系如图所示,其中A代表酸HA,B代表酸HB.下列说法正确的是( )
pH=2的HA、HB两种酸溶液各1mL,分别加水稀释到1000mL,其pH与溶液体积V的关系如图所示,其中A代表酸HA,B代表酸HB.下列说法正确的是( )| A. | 稀释前两酸溶液的物质的量浓度相等 | |
| B. | 稀释后,HA酸溶液的酸性比HB酸溶液强 | |
| C. | a=5时,HA是强酸,HB是弱酸 | |
| D. | 若有等浓度的NaA溶液和NaB溶液,则溶液的碱性NaA>NaB |
8.下列物质性质与应用对应关系正确的是( )
| A. | 乙烯能发生加聚反应,可用于制塑料 | |
| B. | 硝酸具有酸性,可用于实验室制氢气 | |
| C. | 氨气易溶于水,可作制冷剂 | |
| D. | 蛋白质遇CuSO4溶液发生凝聚,可用于提纯蛋白质 |
18.糖类、油脂和蛋白质是人体不可缺少的营养物质,下列有关叙述正确的是( )
| A. | 所有的蛋白质均可通过颜色反应来鉴别 | |
| B. | 淀粉和纤维素表达式为(C6H10O5)n,互为同分异构体 | |
| C. | 糖类、油脂、蛋白质均有C、H、O三种元素组成 | |
| D. | 油脂在碱性条件下水解生成甘油和高级脂肪酸盐 |
5.二氢毗啶是一种新型多功能的饲料添加剂,它的结构简式如下.下列关于二氢毗啶的说法中正确的是( )

| A. | 它易溶于水 | B. | 它属于芳香族化合物 | ||
| C. | 它水解可得到三种有机物 | D. | 它可以发生取代反应和加成反应 |
2.下列有机反应属于同一反应类型的是( )
| A. | 甲烷制一氯甲烷、苯制溴苯 | |
| B. | 乙醇制乙醛、乙醇和乙酸制乙酸乙酯 | |
| C. | 乙醇制乙烯、乙烯制乙醇 | |
| D. | 苯制环己烷、乙酸乙酯水解 |
15.如图所示为反应2H2(g)+O2(g)═2H2O(g)的能量变化示意图.下列说法正确的是( )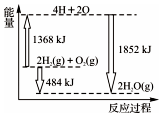

| A. | H2(g)和O2(g)反应生成H2O(g),这是个吸热过程 | |
| B. | 由2 mol H2和1 mol O2变成4 mol H、2 mol O原子,这是个放热过程 | |
| C. | 2 mol H2(g)和1 mol O2(g)反应生成2 mol H2O(g),共放出484 KJ能量 | |
| D. | 4 mol H、2 mol O生成2 mol H2O(g),共放出484 KJ能量 |
