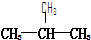
题目内容
下列电离方程式的书写正确的是( )
| A、CuCl2=Cu+Cl2↑ |
| B、Na2CO3=2Na++CO32- |
| C、H2SO4=2H++S6++4O2- |
| D、NaHCO3=Na++H++CO32- |
考点:电离方程式的书写
专题:离子反应专题
分析:A.氯化铜电离出铜离子和氯离子;
B.碳酸钠电离出钠离子和碳酸根离子;
C.硫酸电离出氢离子和硫酸根离子,硫酸根离子不能拆;
D.NaHCO3为强电解质,碳酸为弱电解质,部分电离,碳酸氢根离子不能拆写.
B.碳酸钠电离出钠离子和碳酸根离子;
C.硫酸电离出氢离子和硫酸根离子,硫酸根离子不能拆;
D.NaHCO3为强电解质,碳酸为弱电解质,部分电离,碳酸氢根离子不能拆写.
解答:
解:A.氯化铜为强电解质,完全电离铜离子和氯离子,电离方程式为:CuCl2=Cu2++2Cl-,故A错误;
B.Na2CO3是强电解质在水中完全电离,电离方程式为:Na2CO3=2Na++CO32-,故B正确;
C.硫酸为二元强酸,是强电解质在水中完全电离,电离方程式为:H2SO4═2H++SO42-,故C错误;
D.NaHCO3为强电解质,则电离方程式为:NaHCO3═Na++HCO3-,故D错误;
故选B.
B.Na2CO3是强电解质在水中完全电离,电离方程式为:Na2CO3=2Na++CO32-,故B正确;
C.硫酸为二元强酸,是强电解质在水中完全电离,电离方程式为:H2SO4═2H++SO42-,故C错误;
D.NaHCO3为强电解质,则电离方程式为:NaHCO3═Na++HCO3-,故D错误;
故选B.
点评:本题考查了电离方程式的书写判断,题目难度不大,注意掌握强电解质、弱电解质的判断方法,明确电离方程式的书写原则为解答关键,试题培养了学生规范答题的能力.

练习册系列答案
 黄冈小状元解决问题天天练系列答案
黄冈小状元解决问题天天练系列答案 三点一测快乐周计划系列答案
三点一测快乐周计划系列答案
相关题目
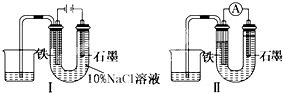 用如图Ⅰ所示装置通电10分钟后,去掉直流电源,连接成图Ⅱ所示装置,可观察到U形管左端铁电极表面析出白色胶状物质,U形管右端液面上升.下列说法正确的是( )
用如图Ⅰ所示装置通电10分钟后,去掉直流电源,连接成图Ⅱ所示装置,可观察到U形管左端铁电极表面析出白色胶状物质,U形管右端液面上升.下列说法正确的是( )| A、用装置Ⅱ进行实验时铁电极的电极反应为Fe-2e-+2OH-=Fe(OH)2 |
| B、装置Ⅰ通电10分钟后铁电极周围溶液pH降低 |
| C、用装置Ⅱ进行实验时石墨电极的电极反应为2H++2e-=H2↑ |
| D、同温、同压下,装置Ⅰ中石墨电极上方得到的气体比铁电极上方得到的气体多 |
设NA为阿伏加德罗常数,下列说法正确的是( )
| A、将1.0molFeCl3全部制成胶体,其中氢氧化铁胶粒为NA个 |
| B、常温常压下,16 g氧气和臭氧(O3)的混合气体中含有NA 个氧原子 |
| C、12g NaHSO4在熔融时离子总数为0.3NA个 |
| D、标准状况下,11.2L氦气所含的原子数为NA个 |
下列说法正确的是( )
| A、CO的摩尔质量为28 |
| B、常温常压下,NA个氢原子与NA 个氮气的质量比为1:14 |
| C、32克O2所含原子数目为2NA |
| D、常温常压下,1molCO分子所占体积是22.4L |
将30mL 0.5mol/L的NaOH溶液加水稀释到500mL,稀释后NaOH的物质的量浓度为( )
| A、0.3mol/L |
| B、0.05mol/L |
| C、0.04mol/L |
| D、0.03mol/L |
A、B、C三种物质各15g,它们发生反应时,只生成30g新物质D.若增加10gC时,A与C恰好完全反应,则A与B参加反应质量之比为( )
| A、1:1 | B、2:1 |
| C、2:3 | D、3:2 |
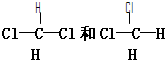 E.CH3CH2CH2CH3和
E.CH3CH2CH2CH3和