题目内容
16.已知将盐酸滴入高锰酸钾溶液中,产生黄绿色气体,而溶液的紫红色褪去.现有一个氧化还原反应的体系中,共有KCl、Cl2、H2SO4、H2O、KMnO4、MnSO4、K2SO4七种物质:(1)该反应中,化合价升高的反应物是KCl,化合价没有发生变化的反应物是H2SO4.
(2)写出一个包含上述七种物质的氧化还原反应方程式(不需配平)KMnO4+KCl+H2SO4→K2SO4+MnSO4+Cl2↑+H2O.
(3)上述反应中,氧化剂是KMnO4,1mol氧化剂在反应中得到(填“得到”或“失去”)5 mol电子.
(4)如果在反应后的溶液中加入NaBiO3溶液又变成紫红色.说出NaBiO3的一个性质:NaBiO3具有强氧化性.
分析 将盐酸滴入高锰酸钾溶液中,产生黄绿色气体,而溶液的紫红色褪去,则发生HCl与KMnO4的氧化还原反应;则七种物质发生KCl+KMnO4+H2SO4→MnSO4+K2SO4+Cl2+H2O,Mn元素的化合价降低,Cl元素的化合价升高,以此来解答.
解答 解:将盐酸滴入高锰酸钾溶液中,产生黄绿色气体,而溶液的紫红色褪去,则发生HCl与KMnO4的氧化还原反应,则七种物质发生KCl+KMnO4+H2SO4→MnSO4+K2SO4+Cl2+H2O,
(1)Cl元素的化合价升高,则KCl为还原剂,化合价没有发生变化的反应物是H2SO4,故答案为:KCl;H2SO4;
(2)由信息可知,高锰酸钾能氧化氯离子,则发生的氧化还原反应为KMnO4+KCl+H2SO4→K2SO4+MnSO4+Cl2↑+H2O,
故答案为:KMnO4+KCl+H2SO4→K2SO4+MnSO4+Cl2↑+H2O;
(3)Mn元素的化合价降低,KMnO4为氧化剂,1mol氧化剂得到1mol×(7-2)=5mol电子,故答案为:KMnO4;得到;5;
(4)加入NaBiO3,溶液又变紫红色,则NaBiO3具有强氧化性,将锰离子氧化为高锰酸根离子,说明NaBiO3将Mn2+氧化成了MnO4-,因而说明NaBiO3的氧化性比KMnO4强;
故答案为:NaBiO3具有强氧化性.
点评 本题考查氧化还原反应及计算,把握习题中的信息及反应中元素的化合价变化为解答的关键,侧重氧化还原反应基本概念及知识迁移应用能力的考查,题目难度不大.

练习册系列答案
 新课标快乐提优暑假作业陕西旅游出版社系列答案
新课标快乐提优暑假作业陕西旅游出版社系列答案
相关题目
6.若NA表示阿伏加德罗常数,下列说法中,正确的是( )
| A. | 1 mol O2作为氧化剂得到的电子数为2NA | |
| B. | 在0℃,101kPa时,22.4 L氢气中含有NA个氢原子 | |
| C. | NA个一氧化碳分子和0.5 mol甲烷的质量比为7:4 | |
| D. | 25℃,1.01×105Pa,64gSO2中含有的原子数为3NA |
4.下列有关物质性质、结构的表述均正确,且存在因果关系的是( )
| 表述1 | 表述2 | |
| A | 在水中,NaCl的溶解度比I2的溶解度大 | NaCl晶体中Cl-与Na+间的作用力大于碘晶体中分子间的作用力 |
| B | 通常条件下,CH4分子比GeH4分子稳定性高 | Ge的原子半径比C的大,Ge与H之间的键能比C与H间的小 |
| C | 向溴乙烷中加入NaOH水溶液,加热反应,再加入AgNO3溶液有浅黄沉淀 | 证明溴乙烷中含有溴原子 |
| D | P4O10、C6H12O6溶于水后均不导电 | P4O10、C6H12O6均属于共价化合物 |
| A. | A | B. | B | C. | C | D. | D |
5.为了检验某含有NaHCO3杂质的Na2CO3样品的纯度,现将w1 g样品加热,其质量变为w2 g,则该样品的纯度(质量分数)是( )
| A. | $\frac{115{w}_{2}-84{w}_{1}}{31{w}_{1}}$ | B. | $\frac{84({w}_{1}-{w}_{2})}{31{w}_{1}}$ | ||
| C. | $\frac{73{w}_{2}-42{w}_{1}}{31{w}_{1}}$ | D. | $\frac{84{w}_{2}-53{w}_{1}}{31{w}_{1}}$ |
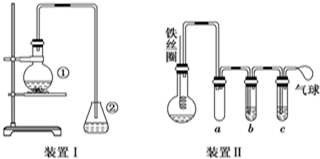
 .
. 与Br2,要想得到纯净的产物,可用NaOH溶液(或水)试剂洗涤.洗涤后分离粗产品应使用的仪器是分液漏斗.
与Br2,要想得到纯净的产物,可用NaOH溶液(或水)试剂洗涤.洗涤后分离粗产品应使用的仪器是分液漏斗. .
.

 ,A的结构简式
,A的结构简式 .
. .
. .
.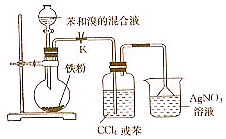 实验室用如图所示装置进行苯与溴反应的实验,请回答下列问题.
实验室用如图所示装置进行苯与溴反应的实验,请回答下列问题. +Br2$\stackrel{FeBr_{3}}{→}$
+Br2$\stackrel{FeBr_{3}}{→}$ +HBr.
+HBr.

 .
. .
.
 .
.