题目内容
混合下列各组物质使之充分反应,加热蒸干产物并在300℃灼烧至质量不变,最终残留固体为纯净物的是( )
| A、NaAlO2溶液和过量硫酸 |
| B、等物质的量的NaHCO3和Na2O2固体 |
| C、FeSO4溶液和过量溴水 |
| D、溶质的物质的量相同的(NH4)2SO4溶液和BaCl2溶液 |
考点:镁、铝的重要化合物,氯、溴、碘及其化合物的综合应用,钠的重要化合物
专题:元素及其化合物
分析:A、NaAlO2溶液和过量硫酸反应生成硫酸钠、硫酸铝和水,加热硫酸铝蒸干并灼烧后还是硫酸铝;
B、发生的反应为:
Na2O2 +H2O=2NaOH+
O2
NaHCO3 +NaOH=Na2CO3+H2O
由于Na2O2与NaHCO3等物质的量,所以NaOH是NaHCO3量的二倍,所以NaOH过量;
C、FeSO4溶液和过量溴水发生氧化还原反应生成硫酸铁,溴化铁等,加热硫酸铁蒸干产物并在300℃灼烧后还是硫酸铁,加热溴化铁会水解生成氢氧化铁,蒸干溶液继续灼烧,则氢氧化铁分解生成氧化铁;
D、等物质的量浓度、等体积的(NH4)2SO4溶液与BaCl2溶液混合恰好生成硫酸钡和氯化铵.
B、发生的反应为:
Na2O2 +H2O=2NaOH+
| 1 |
| 2 |
NaHCO3 +NaOH=Na2CO3+H2O
由于Na2O2与NaHCO3等物质的量,所以NaOH是NaHCO3量的二倍,所以NaOH过量;
C、FeSO4溶液和过量溴水发生氧化还原反应生成硫酸铁,溴化铁等,加热硫酸铁蒸干产物并在300℃灼烧后还是硫酸铁,加热溴化铁会水解生成氢氧化铁,蒸干溶液继续灼烧,则氢氧化铁分解生成氧化铁;
D、等物质的量浓度、等体积的(NH4)2SO4溶液与BaCl2溶液混合恰好生成硫酸钡和氯化铵.
解答:
解:A、NaAlO2溶液和过量硫酸反应生成硫酸钠、硫酸铝和水,加热硫酸铝蒸干并灼烧后还是硫酸铝,硫酸钠还是硫酸钠,故NaAlO2溶液和过量硫酸加热蒸干并在300℃灼烧至质量不变,最终残留固体为硫酸钠和硫酸铝的混合物,故A错误;
B、发生的反应为:
Na2O2 +H2O=2NaOH+
O2
NaHCO3 +NaOH=Na2CO3+H2O
由于Na2O2与NaHCO3等物质的量,所以NaOH是NaHCO3量的二倍,所以NaOH过量,因此残留固体是碳酸钠和氢氧化钠的混合物,故B错误;
C、FeSO4溶液和过量溴水发生氧化还原反应生成硫酸铁,溴化铁等,加热硫酸铁蒸干产物并在300℃灼烧后还是硫酸铁,加热溴化铁会水解生成氢氧化铁,蒸干溶液继续灼烧,则氢氧化铁分解生成氧化铁;故FeSO4溶液和过量溴水加热蒸干并在300℃灼烧至质量不变,最终残留固体为氧化铁和硫酸铁的混合物,故C错误;
D、等物质的量浓度、等体积的(NH4)2SO4溶液与BaCl2溶液混合恰好生成硫酸钡和氯化铵,氯化铵加热分解,加热蒸干、灼烧,氯化铵分解,残留固体为硫酸钡,故D正确;
故选D.
B、发生的反应为:
Na2O2 +H2O=2NaOH+
| 1 |
| 2 |
NaHCO3 +NaOH=Na2CO3+H2O
由于Na2O2与NaHCO3等物质的量,所以NaOH是NaHCO3量的二倍,所以NaOH过量,因此残留固体是碳酸钠和氢氧化钠的混合物,故B错误;
C、FeSO4溶液和过量溴水发生氧化还原反应生成硫酸铁,溴化铁等,加热硫酸铁蒸干产物并在300℃灼烧后还是硫酸铁,加热溴化铁会水解生成氢氧化铁,蒸干溶液继续灼烧,则氢氧化铁分解生成氧化铁;故FeSO4溶液和过量溴水加热蒸干并在300℃灼烧至质量不变,最终残留固体为氧化铁和硫酸铁的混合物,故C错误;
D、等物质的量浓度、等体积的(NH4)2SO4溶液与BaCl2溶液混合恰好生成硫酸钡和氯化铵,氯化铵加热分解,加热蒸干、灼烧,氯化铵分解,残留固体为硫酸钡,故D正确;
故选D.
点评:考查物质之间的反应及物质性质,涉及过量问题,难度中等,注意水解和分解.

练习册系列答案
相关题目
检验淀粉已完全水解的试剂( )
| A、新制的Cu(OH)2悬浊液 |
| B、碘水 |
| C、NaOH溶液 |
| D、稀硫酸 |
下列选项中正确的是( )
| A、甲苯和二氯乙烯分子中所有原子共平面 |
| B、1-丁烯既能发生取代反应,又能发生加成反应,但不能被氧化 |
| C、由甲苯制三硝基甲苯和苯甲酸都属于取代反应 |
| D、分子式为C3H6Cl2的同分异构体有4种 |
随着人们生活质量的提高,废电池必须集中处理的问题被提上议事日程,其首要原因是( )
| A、利用电池外壳的金属材料 |
| B、防止电池中汞、镉、铅等重金属离子对土壤和水源的污染 |
| C、回收其中的石墨电极 |
| D、不使电池中渗出的电解液腐蚀其他物品 |
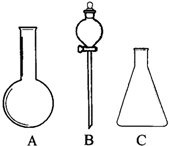 (1)有如图所示A、B、C三种仪器:请选择下列仪器名称的序号,填入相应的空格内:①烧杯②普通漏斗③圆底烧瓶④锥形瓶⑤分液漏斗⑥酸式滴定管
(1)有如图所示A、B、C三种仪器:请选择下列仪器名称的序号,填入相应的空格内:①烧杯②普通漏斗③圆底烧瓶④锥形瓶⑤分液漏斗⑥酸式滴定管