题目内容
7. 镁和铝分别与等浓度、等体积的过量稀硫酸反应,产生 气体的体积(V)与时间(t)关系如图.反应中镁和铝的( )
镁和铝分别与等浓度、等体积的过量稀硫酸反应,产生 气体的体积(V)与时间(t)关系如图.反应中镁和铝的( )| A. | 摩尔质量之比为 2:3 | B. | 物质的量之比为 3:2 | ||
| C. | 质量之比为 3:2 | D. | 反应速率之比为 3:2 |
分析 根据图象可知,镁和铝分别与等浓度、等体积的过量稀硫酸反应,两种金属得到的氢气一样多,说明转移电子数相等,然后结合金属镁、铝和足量的稀硫酸反应的化学方程式:Mg+H2SO4=MgSO4+H2↑、2Al+3H2SO4=Al2(SO4)3+3H2↑进行分析解答.
解答 解:A.Mg的摩尔质量是24g/mol,铝的摩尔质量是27g/mol,其摩尔质量之比=24g/mol:27g/mol=8:9,故A错误;
B.由于Mg~H2,2Al~3H2,且两种金属得到的氢气一样多,因此镁和铝的物质的量的比是1:$\frac{2}{3}$=3:2,故B正确;
C.根据B知,二者的物质的量之比为3:2,根据m=nM知,二者的质量的比为(3×24):(2×27)=4:3,故C错误;
D.根据v=$\frac{△c}{△t}$知,当气体体积相同时,反应速率与其时间成反比,所以二者反应速率之比3:2,故D正确;
故选:BD.
点评 本题以图象形式考查混合物计算、金属与酸的反应,难度不大,注意结合方程式进行分析解答,知道相同条件下,物质反应速率取决于物质本身的性质.

练习册系列答案
 活力课时同步练习册系列答案
活力课时同步练习册系列答案 学业测评一课一测系列答案
学业测评一课一测系列答案
相关题目
18.为了提纯表所列物质(括号内为杂质),有关除杂试剂和分离方法的选择均不正确的是( )
| 编号 | 被提纯的物质 | 除杂试剂 | 分离方法 |
| A | 乙烷(乙烯) | 溴水 | 洗气 |
| B | 淀粉溶液(NaCl) | 水 | 过滤 |
| C | 乙醇(水) | CaO | 蒸馏 |
| D | 乙酸乙酯(乙酸) | 饱和Na2CO3溶液 | 分液 |
| A. | A | B. | B | C. | C | D. | D |
19.在铅蓄电池的充放电过程中,涉及不到的物质是( )
| A. | PbS | B. | PbO2 | C. | PbSO4 | D. | Pb |
16.下列说法正确的是( )
| A. | 126C、136C、146C三种核素互为同素异形体 | |
| B. | 溶液、胶体和悬浊液这三种分散系的本质区别是能否透过滤纸或半透膜 | |
| C. | 等质量的甲烷按a,b两种途径完全转化,途径a比途径b消耗更多的O2 途径a:CH4$→_{催化重整}^{H_{2}O}$CO+H2$→_{燃烧}^{O_{2}}$CO2+H2O;途径b:CH4$→_{燃烧}^{O_{2}}$CO2+H2O | |
| D. | 铝热反应实验说明:在一定条件下铝的还原性强于很多难熔金属 |
2. 金属(M)-空气电池(如图)具有原料易得、能量密度高等优点,有望成为新能源汽车和移动设备的 电源.该类电池放电的总反应方程式为:4M+nO2+2nH2O═4M(OH) n.已知:电池的“理论比能量”指单位质量的电极材料理论上能释放出的最大电能.下列说法不正确的是( )
金属(M)-空气电池(如图)具有原料易得、能量密度高等优点,有望成为新能源汽车和移动设备的 电源.该类电池放电的总反应方程式为:4M+nO2+2nH2O═4M(OH) n.已知:电池的“理论比能量”指单位质量的电极材料理论上能释放出的最大电能.下列说法不正确的是( )
 金属(M)-空气电池(如图)具有原料易得、能量密度高等优点,有望成为新能源汽车和移动设备的 电源.该类电池放电的总反应方程式为:4M+nO2+2nH2O═4M(OH) n.已知:电池的“理论比能量”指单位质量的电极材料理论上能释放出的最大电能.下列说法不正确的是( )
金属(M)-空气电池(如图)具有原料易得、能量密度高等优点,有望成为新能源汽车和移动设备的 电源.该类电池放电的总反应方程式为:4M+nO2+2nH2O═4M(OH) n.已知:电池的“理论比能量”指单位质量的电极材料理论上能释放出的最大电能.下列说法不正确的是( )| A. | 采用多孔电极的目的是提高电极与电解质溶液 的接触面积,并有利于氧气扩散至电极表面 | |
| B. | M-空气电池放电过程的正极反应式:4Mn++nO2+2nH2O+4ne-═4M(OH)n | |
| C. | 比较 Mg、Al、Zn 三种金属-空气电池,Al-空气电池的理论比能量最高 | |
| D. | 在 Mg-空气电池中,为防止负极区沉积Mg(OH)2,宜采用中性电解质及阳离子交换膜 |
12.根据元素周期律,下列推断不正确的是( )
| A. | 原子半径:Na>Mg>Al>O>F | B. | 离子半径:O>F>Na>Mg>Al | ||
| C. | 酸性:H3PO4<H2SO4<HClO4 | D. | 碱性:RbOH<KOH<NaOH |
19.下列物质在空气中不易变质的是( )
| A. | FeSO4 | B. | NaClO | C. | Na2SiO3 | D. | NaHSO4 |
16.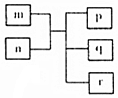 短周期主族元素X、Y、Z、W原子序数依次递增,Y原子最外层电子数为次外层电子数的二倍.m为元素Y的单质,n为元素Z的最高价氧化物的水化物,p、q、r分别为上述四种元素组成的二元化合物.下列说法正确的是( )
短周期主族元素X、Y、Z、W原子序数依次递增,Y原子最外层电子数为次外层电子数的二倍.m为元素Y的单质,n为元素Z的最高价氧化物的水化物,p、q、r分别为上述四种元素组成的二元化合物.下列说法正确的是( )
 短周期主族元素X、Y、Z、W原子序数依次递增,Y原子最外层电子数为次外层电子数的二倍.m为元素Y的单质,n为元素Z的最高价氧化物的水化物,p、q、r分别为上述四种元素组成的二元化合物.下列说法正确的是( )
短周期主族元素X、Y、Z、W原子序数依次递增,Y原子最外层电子数为次外层电子数的二倍.m为元素Y的单质,n为元素Z的最高价氧化物的水化物,p、q、r分别为上述四种元素组成的二元化合物.下列说法正确的是( )| A. | 原子半径Y<Z<W | |
| B. | 简单气态氢化物的稳定性Y>Z>W | |
| C. | X与Z形成的化合物的水溶液一定为酸性溶液 | |
| D. | X、Z、W三种元素可以形成离子化合物 |

 .
.