题目内容
3.硫的化合物与生产、生活、科技等密切相关.请回答下列问题:(1)辉铜矿(Cu2S)在高温条件下发生如下反应:2Cu2S+3O2═2Cu20+2SO2△H=-773kJ•mol-1
当放出154.6kJ热量时,反应过程中转移电子的物质的量为2.4mol.
(2)某研究小组把钢铁中的硫转化为H2SO3溶液,然后用标准浓度的I2溶液进行滴定.标准浓度的I2溶液所用滴定管为酸式(填“酸式”或“碱式”)滴定管,滴定中使用的指示剂的名称为淀粉试液,反应的离子方程为H2SO3+I2+H2O=4H++SO42-+2I-.
(3)利用反应2SO2+O2+2H20═2H2SO4,可以处理SO2尾气,若将该反应设计为稀硫酸作电解质的原电池,其负极反应式为SO2+2H2O-2e-═4H++SO42-,反应一段时间后,溶液的pH将减小(填:“增大”、“不变”或“减小”).
(4)现将NaCl和NaHCO3混合液、CuSO4溶液各400ml.分別盛放在两电解池中,将插入两溶液中的惰性电扱串联,以电池为电源进行电解.
①刚开始时,NaCl和NaHCO3混合液阴极反应式为2H++2e-═H2↑,NaCl和NaHCO3混合液的pH升高的比较缓慢,原因是产生的氢氧根离子与碳酸氢根离子反应生成碳酸根和水,导致PH缓慢变化.
②向电解后的CuSO4溶液中加入0.01molCu2(OH)2CO3恰好使该溶液恢复原来的状态,則电路中转移电子的物质的最为0.06.当有0.04mol电子发生转移时,该溶液的pH=1(不考虑溶液体积变化)
分析 (1)根据反应热和转移电子之间的关系式计算;
(2)I2溶液滴定管为酸式滴定管,因为I2遇到淀粉会变蓝色,所以可以用淀粉溶液作指示剂;根据氧化还原反应书写化学方程式;
(3)根据原电池原理,正极发生的是化合价降低得电子的反应,负极发生氧化反应,根据电极反应判断pH的变化;
(4)现将NaCl和NaHCO3混合液、CuSO4溶液各400ml.分別盛放在两电解池中,将插入两溶液中的惰性电扱串联,以电池为电源进行电解.
①刚开始时,NaCl和NaHCO3混合液阴极发生还原反应,电极反应式为2H++2e-═H2↑,NaCl和NaHCO3混合液的pH升高的比较缓慢,原因是反应产生的氢氧根离子与碳酸氢根离子反应生成碳酸根和水,导致PH缓慢变化;
②电解硫酸铜溶液后溶液呈酸性,向电解后的溶液中加入碱式碳酸铜能恢复原溶液,碱式碳酸铜和硫酸反应生成硫酸铜、水和二氧化碳,溶液质量增加的量是铜、氢氧根离子,所以实际上电解硫酸铜溶液分两个阶段:第一阶段2CuSO4+2H2O$\frac{\underline{\;通电\;}}{\;}$2Cu+O2↑+2H2SO4,第二阶段:2H2O$\frac{\underline{\;通电\;}}{\;}$2H2↑+O2↑,
将碱式碳酸铜化学式改变为2CuO•H2O•CO2,所以加入0.1molCu2(OH)2CO3 就相当于加入0.2molCuO和0.1mol水,根据氧化铜和水的量计算即可.
解答 解:(1)该反应2Cu2S(s)+3O2(g)═2Cu2O(s)+2SO2(g)中,当转移12mol电子时放出773kJ热量,当放出热量154.6kJ热量转移2.4mol电子时,
故答案为:2.4mol;
(2)I2溶液滴定管为酸式滴定管,因为I2遇到淀粉会变蓝色,所以可以用淀粉溶液作指示剂,滴定终点时溶液的颜色变化为无色变为蓝色,反应的离子方程式为H2SO3+I2+H2O=4H++SO42-+2I-;故答案为:酸式;淀粉试液;H2SO3+I2+H2O=4H++SO42-+2I-;
(3)原电池负极发生的是化合价升高失电子的反应,根据方程式可知是二氧化硫失电子,另外,由于H2SO4存在,所以电极反应:SO2+2H2O-2e-═4H++SO42-,该过程T生成氢离子,所以负极pH会减小,
故答案为:SO2+2H2O-2e-═4H++SO42-;减小;
(4)现将NaCl和NaHCO3混合液、CuSO4溶液各400ml.分別盛放在两电解池中,将插入两溶液中的惰性电扱串联,以电池为电源进行电解.
①刚开始时,NaCl和NaHCO3混合液阴极发生还原反应,电极反应式为2H++2e-═H2↑,NaCl和NaHCO3混合液的pH升高的比较缓慢,原因是反应产生的氢氧根离子与碳酸氢根离子反应生成碳酸根和水,导致PH缓慢变化,
故答案为:2H++2e-═H2↑;产生的氢氧根离子与碳酸氢根离子反应生成碳酸根和水,导致PH缓慢变化;
②电解硫酸铜溶液后溶液呈酸性,向电解后的溶液中加入碱式碳酸铜能恢复原溶液,碱式碳酸铜和硫酸反应生成硫酸铜、水和二氧化碳,溶液质量增加的量是铜、氢氧根离子,所以实际上电解硫酸铜溶液分两个阶段:
第一阶段2CuSO4+2H2O$\frac{\underline{\;通电\;}}{\;}$2Cu+O2↑+2H2SO4,
第二阶段:2H2O$\frac{\underline{\;通电\;}}{\;}$2H2↑+O2↑,
将碱式碳酸铜化学式改变为2CuO•H2O•CO2,所以加入0.01molCu2(OH)2CO3 就相当于加入0.02molCuO和0.01mol水,
第一阶段:根据铜原子守恒知,电解硫酸铜溶液析出n(Cu)=n(CuO)=0.02mol,转移电子的物质的量=0.02mol×2=0.04mol;
第二阶段:电解生成0.01mol水转移电子的物质的量=0.01mol×2=0.02mol,
所以电解过程中共转移的电子数为0.04mol+0.02mol=0.06mol,当有0.04mol电子发生转移时,此时0.02molH2SO4,而体积为:400ml,所以该溶液中氢离子的浓度为:$\frac{0.02×2}{0.4}$=0.1mol/L,所以溶液的pH=1,故答案为:0.06;1.
点评 本题考查电解原理、氧化还原反应等,清楚发生的电极反应是解题的关键,是对学生综合能力的考查,难度中等.

 导学教程高中新课标系列答案
导学教程高中新课标系列答案| A. | 溶解、过滤、蒸发、洗涤 | B. | 溶解、蒸发、洗涤、过滤 | ||
| C. | 溶解、过滤、洗涤、干燥 | D. | 溶解、洗涤、过滤、干燥 |
| A. | 使酚酞变红的溶液中,这些离子不可大量共存:Cl-,S2-,SO32-,K+ | |
| B. | 向CH3COOH溶液中滴加NaOH的过程中,计算式$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)•c(O{H}^{-})}$的值始终不变 | |
| C. | 苯酚钠溶液中通入少量CO2,发生反应:2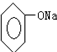 +H2O+CO2→2 +H2O+CO2→2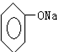 +Na2CO3 +Na2CO3 | |
| D. | 硝酸亚铁溶液中滴入盐酸的离子反应方程式为:3Fe2++4H++NO3-═3Fe3++NO+2H2O |
| 反应阶段 | Ⅰ | Ⅱ | Ⅲ |
| 盐酸体积x/mL | 0<x≤10.0 | 10.0<x≤40.0 | x>40.0 |
| 现 象 | 无气体 | 产生气体 | 无气体 |
(1)配制0.10mol•L-1的稀盐酸250mL,需要10.0mol•L-1的浓盐酸的体积为2.5mL.
(2)计算样品溶液中碳酸根离子的物质的量浓度.
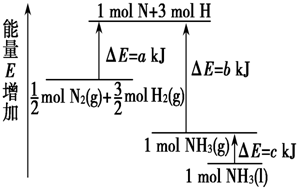
| A. | N2(g)+3H2(g)═2NH3(l)△H=2(a-b-c) kJ•mol-1 | |
| B. | N2(g)+3H2(g)═2NH3(g)△H=2(b-a) kJ•mol-1 | |
| C. | $\frac{1}{2}$N2(g)+$\frac{3}{2}$H2(g)═NH3(l)△H=2(b+c-a) kJ•mol-1 | |
| D. | $\frac{1}{2}$N2(g)+$\frac{3}{2}$H2(g)═NH3(g)△H=2(a+b) kJ•mol-1 |
| A. | 质量都为4.4g的CH3CHO和CO2含有的分子数均为0.1NA | |
| B. | 1molNa2O2中的离子总数为4NA | |
| C. | 密闭容器中,2molSO2和足量的O2反应转移的电子数为4NA | |
| D. | 1mol苯分子中所含的碳碳双键数为3NA |
| A. | 闻名世界的中国陶瓷、酿酒、造纸技术都充分应用了化学工艺 | |
| B. | 四大发明之一黑火药是由硫黄、硝石、木炭三种物质按一定比例混合制成 | |
| C. | 工业上电解熔融状态的Al2O3制备Al | |
| D. | 为预防碘缺乏病,在食盐中加入碘单质 |
| A. | “NO2球”浸泡在冷水中,颜色变浅:2 NO2(g)?N2O4(g)△H<0 | |
| B. | 在反应FeCl3+3KSCN?Fe(SCN)3+3KCl 达平衡后,加入少量KCl固体,平衡逆向移动 | |
| C. | 在两支盛有双氧水的试管中,一支加入FeCl3溶液,反应明显加快,而另一支中加入CuSO4溶液,反应加快但不明显,说明催化剂具有较强选择性 | |
| D. | 用MnO2做催化剂,催化双氧水的分解,是因为MnO2可降低该反应活化能,提高活化分子的百分数 |