题目内容
1.催化剂在生产和科技领域起到重大作用.为比较Fe3+、Cu2+和MnO2对H2O2分解反应的催化效果,某化学研究小组的同学分别设计了如图甲、乙所示的实验.请回答相关问题: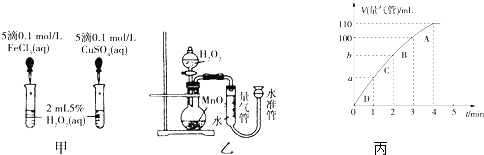
(1)同学X观察甲中两支试管产生气泡的快慢,由此得出Fe3+和Cu2+对H2O2分解的催化效果,其结论不合理(填“合理”或“不合理”),理由是阴离子种类不同.
(2)同学Y利用乙装置探究MnO2对H2O2分解的催化效果.将50mL H2O2一次性加入盛有0.10mol MnO2粉末的烧瓶中,测得标准状况下由量气管读出气体的体积[V(量气管)/mL]和时间(t/min)的关系如图丙所示.
①实验时放出气体的总体积是60 mL.
②b小于(填“大于”“小于”或“等于”)90mL.
③同学Y除了探究MnO2对H2O2分解速率的影响情况,还可得出反应物浓度对H2O2分解速率的影响情况.
分析 (1)比较反应速率的大小可通过生成气泡的快慢来判断,比较金属阳离子的催化效果要排斥阴离子的干扰;
(2)①根据图象确定生成氧气的体积;
②根据图象斜率判断反应速率快慢;
③反应过程催化剂没变,但反应物的浓度降低,反应速率减小;
解答 解:(1)催化剂能改变化学反应的速率,这里是加快速率,若图1所示实验中反应速率为①>②,则一定说明氯化铁比硫酸铜催化效果好,因二者所含的阴离子不同,要证明Fe3+比Cu2+对H2O2分解催化效果好,还要使选择的试剂中阴离子种类相同,所以得出Fe3+和Cu2+对H2O2分解的催化效果,其结论不合理,故答案为:不合理;阴离子种类不同;
(2)①根据图象知,第4分钟时,随着时间的推移,气体体积不变,所以实验时放出气体的总体积是60 mL,故答案为:60;
②图象斜率的大小反映反应速率快慢,斜率越大,反应速率越快,将50mL H2O2一次性加入盛有0.10mol MnO2粉末的烧瓶中,由于反应物浓度减小,反应速率减小,3min~4min生成10mL气体,那么2min~3min生成气体的体积应大于10mL,故b小于90mL,故答案为:小于;
③在加入催化剂的条件下随着反应物浓度的降低,反应速率减小,故答案为:反应物浓度.
点评 本题考查了影响反应速率的因素,题目难度中等,解答须理清化学反应速率与催化剂间的关系以及速率与图象间的关系.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
19.钙和钠相似,也能形成过氧化物,则下列叙述正确的是( )
| A. | 过氧化钙的化学式是Ca2O2 | |
| B. | 1mol过氧化钠或过氧化钙跟足量水反应都生成0.5mol氧气 | |
| C. | 过氧化钙中阴阳离子数之比为2:1 | |
| D. | 过氧化钙中只含离子键 |
17.下列分散系中,适宜用过滤的方法将分散质与分散剂分离的是( )
| A. | 溶液 | B. | 胶体 | ||
| C. | 悬浊液 | D. | 互不相容的两种液体 |
4.标准状况下,112ml,某气体的质量为0.29g,该气体的摩尔质量约为( )
| A. | 29g•mol-1 | B. | 29g | C. | 58g•mol-1 | D. | 58g |
6.固体X中可能含有MgCl2、Na2CO3、Na2SO3、KAlO2中的一种或几种.现取固体X进行实验,实验过程及现象如下:
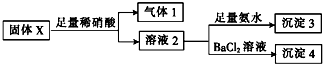
根据上述实验,下列说法正确的是( )

根据上述实验,下列说法正确的是( )
| A. | 气体1一定含NO可能含CO2 | |
| B. | 沉淀3一定含Mg(OH)2一定不含Al(OH)3 | |
| C. | 沉淀4可能为BaCO3、BaSO3或二者混合物 | |
| D. | 固体粉末X中一定有MgCl2和Na2SO3,可能有KAlO2 |
13. 以石墨电极电解200mL CuSO4溶液,电解过程中电子转移物质的量n(e-)与产生气体体积V (g)(标准状况)的关系如图所示.下列说法中,正确的是( )
以石墨电极电解200mL CuSO4溶液,电解过程中电子转移物质的量n(e-)与产生气体体积V (g)(标准状况)的关系如图所示.下列说法中,正确的是( )
 以石墨电极电解200mL CuSO4溶液,电解过程中电子转移物质的量n(e-)与产生气体体积V (g)(标准状况)的关系如图所示.下列说法中,正确的是( )
以石墨电极电解200mL CuSO4溶液,电解过程中电子转移物质的量n(e-)与产生气体体积V (g)(标准状况)的关系如图所示.下列说法中,正确的是( )| A. | 电解前CuSO4溶液的物质的量浓度为2mol/L | |
| B. | 电解后所得溶液中c(H+)=2mol/L | |
| C. | 当n(e-)=0.6mol时,V(H2):V(O2)=2:3 | |
| D. | 向电解后的溶液中加入16gCuO,则溶液可恢复为电解前的浓度 |
11.某溶液可能含有Na+、Ag+、Al3+、S2-、CO32-、SO42-、NO3-等离子中的数种.向此溶液中加入稀盐酸,有浅黄色沉淀和气体出现,此溶液的焰色为黄色.根据以上实验现象,下列关于原溶液中离子成分的推测正确的是( )
| A. | 一定有S2-、SO32-、Na+ | B. | 一定没有Ag+、Al3+ | ||
| C. | 可能只有Na+、S2-、CO32- | D. | 一定有Na+、S2-、NO3 |