题目内容
铜、铁都是日常生活中常见的金属,它们的单质及其化合物在科学研究和工农业生产中具有广泛用途.
请回答以下问题:
(1)超细铜粉可用作导电材料、催化剂等,其制备方法如下:

①Cu2+的价电子排布图 ; NH4CuSO3中N、O、S三种元素的第一电离能由大到小顺序为 (填元素符号).
②SO42-的空间构型为 ,SO32-离子中心原子的杂化方式为 .
(2)请写出向Cu(NH3)4SO4水溶液中通入SO2时发生反应的离子方程式: .
(3)某学生向CuSO4溶液中加入少量氨水生成蓝色沉淀,继续加入过量氨水沉淀溶解,得到深蓝色透明溶液,最后向该溶液中加入一定量乙醇,析出[Cu(NH3)4]SO4?H2O晶体.
①下列说法正确的是
a.氨气极易溶于水,是因为NH3分子和H2O分子之间形成3种不同的氢键
b.NH3分子和H2O分子,分子空间构型不同,氨气分子的键角小于水分子的键角
c.Cu(NH3)4SO4所含有的化学键有离子键、极性共价键和配位键
d.Cu(NH3)4SO4组成元素中电负性最大的是氮元素
②请解释加入乙醇后析出晶体的原因 .
(4)Cu晶体的堆积方式如图所示,设Cu原子半径为r,晶体中Cu原子的配位数为 ,晶体的空间利用率为 (
≈1.4,列式并计算结果).

请回答以下问题:
(1)超细铜粉可用作导电材料、催化剂等,其制备方法如下:

①Cu2+的价电子排布图
②SO42-的空间构型为
(2)请写出向Cu(NH3)4SO4水溶液中通入SO2时发生反应的离子方程式:
(3)某学生向CuSO4溶液中加入少量氨水生成蓝色沉淀,继续加入过量氨水沉淀溶解,得到深蓝色透明溶液,最后向该溶液中加入一定量乙醇,析出[Cu(NH3)4]SO4?H2O晶体.
①下列说法正确的是
a.氨气极易溶于水,是因为NH3分子和H2O分子之间形成3种不同的氢键
b.NH3分子和H2O分子,分子空间构型不同,氨气分子的键角小于水分子的键角
c.Cu(NH3)4SO4所含有的化学键有离子键、极性共价键和配位键
d.Cu(NH3)4SO4组成元素中电负性最大的是氮元素
②请解释加入乙醇后析出晶体的原因
(4)Cu晶体的堆积方式如图所示,设Cu原子半径为r,晶体中Cu原子的配位数为
| 2 |

考点:制备实验方案的设计,晶胞的计算
专题:实验设计题
分析:(1)①Cu2+的价层电子数是9个,所以Cu2+的价电子排布图为 ;N、O、S三种元素中由于N原子的2p轨道是半充满状态,所以第一电离能最大;同主族元素,随电子层数的增多,第一电离能逐渐减小;
;N、O、S三种元素中由于N原子的2p轨道是半充满状态,所以第一电离能最大;同主族元素,随电子层数的增多,第一电离能逐渐减小;
②SO42-的价层电子对数=4+
(6+2-4×2)=4,所以空间构型为正四面体型;SO32-离子的价层电子对数=3+
(6+2-3×2)=4,所以中心原子的杂化方式为sp3杂化;
(2)由流程图可知向Cu(NH3)4SO4水溶液中通入SO2时生成白色沉淀,根据所给沉淀的化学式书写离子方程式;
(3)①a.氨气极易溶于水,是因为NH3分子和H2O分子之间形成2种不同的氢键,N与H,O与H之间;
b.NH3分子和H2O分子,分子空间构型不同,氨气是三角锥型,水是角形,氨气分子的键角大于水分子的键角;
c. Cu(NH3)4SO4所含有的化学键有离子键、极性共价键和配位键,硫酸根离子与配离子之间是离子键,N与H之间是共价键,氨气与铜离子之间是配位键;
d. Cu(NH3)4SO4组成元素中电负性最大的是氧元素;
②根据相似相容原理,极性分子易溶于极性溶剂,乙醇分子极性比水分子极性弱,加入乙醇降低溶剂的极性,从而减小溶质的溶解度;
(4)Cu晶体的堆积方式是面心立方最密堆积,所以配位数是12;由图可知,立方体的面的对角线长是4r,所以立方体的棱长a=2
r,1个Cu的体积是4/3πr3,晶胞中Cu原子的个数是4个,所以晶体的空间利用率为
;
 ;N、O、S三种元素中由于N原子的2p轨道是半充满状态,所以第一电离能最大;同主族元素,随电子层数的增多,第一电离能逐渐减小;
;N、O、S三种元素中由于N原子的2p轨道是半充满状态,所以第一电离能最大;同主族元素,随电子层数的增多,第一电离能逐渐减小;②SO42-的价层电子对数=4+
| 1 |
| 2 |
| 1 |
| 2 |
(2)由流程图可知向Cu(NH3)4SO4水溶液中通入SO2时生成白色沉淀,根据所给沉淀的化学式书写离子方程式;
(3)①a.氨气极易溶于水,是因为NH3分子和H2O分子之间形成2种不同的氢键,N与H,O与H之间;
b.NH3分子和H2O分子,分子空间构型不同,氨气是三角锥型,水是角形,氨气分子的键角大于水分子的键角;
c. Cu(NH3)4SO4所含有的化学键有离子键、极性共价键和配位键,硫酸根离子与配离子之间是离子键,N与H之间是共价键,氨气与铜离子之间是配位键;
d. Cu(NH3)4SO4组成元素中电负性最大的是氧元素;
②根据相似相容原理,极性分子易溶于极性溶剂,乙醇分子极性比水分子极性弱,加入乙醇降低溶剂的极性,从而减小溶质的溶解度;
(4)Cu晶体的堆积方式是面心立方最密堆积,所以配位数是12;由图可知,立方体的面的对角线长是4r,所以立方体的棱长a=2
| 2 |
4×
| ||
| a3 |
解答:
解:(1)①Cu2+的价层电子数是9个,所以Cu2+的价电子排布图为 ;N、O、S三种元素中由于N原子的2p轨道是半充满状态,所以第一电离能最大;同主族元素,随电子层数的增多,第一电离能逐渐减小,所以3种元素的第一电离能由大到小顺序为:N>O>S;
;N、O、S三种元素中由于N原子的2p轨道是半充满状态,所以第一电离能最大;同主族元素,随电子层数的增多,第一电离能逐渐减小,所以3种元素的第一电离能由大到小顺序为:N>O>S;
故答案为: ,N>O>S;
,N>O>S;
②SO42-的价层电子对数=4+
(6+2-4×2)=4,所以空间构型为正四面体型;SO32-离子的价层电子对数=3+
(6+2-3×2)=4,所以中心原子的杂化方式为sp3杂化;
故答案为:正四面体形,sp3杂化;
(2)由流程图可知向Cu(NH3)4SO4水溶液中通入SO2时生成白色沉淀,根据所给沉淀的化学式书写离子方程式,所以离子方程式为:2Cu(NH3)42++3SO2+4H2O=2NH4CuSO3↓+6NH4++SO42-;
故答案为:2Cu(NH3)42++3SO2+4H2O=2NH4CuSO3↓+6NH4++SO42-;
(3)①a.氨气极易溶于水,是因为NH3分子和H2O分子之间形成2种不同的氢键,N与H,O与H之间,故a错误;
b.NH3分子和H2O分子,分子空间构型不同,氨气是三角锥型,水是角形,氨气分子的键角大于水分子的键角,故b 错误;
c. Cu(NH3)4SO4所含有的化学键有离子键、极性共价键和配位键,硫酸根离子与配离子之间是离子键,N与H之间是共价键,氨气与铜离子之间是配位键,故c正确;
d. Cu(NH3)4SO4组成元素中电负性最大的是氧元素,故d错误,
故答案为:c;
②根据相似相容原理,极性分子易溶于极性溶剂,乙醇分子极性比水分子极性弱,加入乙醇降低溶剂的极性,从而减小溶质的溶解度;
故答案为:乙醇分子极性比水分子极性弱,加入乙醇降低溶剂的极性,从而减小溶质的溶解度;
(4)Cu晶体的堆积方式是面心立方最密堆积,所以配位数是12;由图可知,立方体的面的对角线长是4r,所以立方体的棱长a=2
r,1个Cu的体积是
πr3,晶胞中Cu原子的个数是4个,所以晶体的空间利用率为4×
πr3/a3=
×100%=74.76%.
故答案为:=
×100%=74.76%.
 ;N、O、S三种元素中由于N原子的2p轨道是半充满状态,所以第一电离能最大;同主族元素,随电子层数的增多,第一电离能逐渐减小,所以3种元素的第一电离能由大到小顺序为:N>O>S;
;N、O、S三种元素中由于N原子的2p轨道是半充满状态,所以第一电离能最大;同主族元素,随电子层数的增多,第一电离能逐渐减小,所以3种元素的第一电离能由大到小顺序为:N>O>S;故答案为:
 ,N>O>S;
,N>O>S;②SO42-的价层电子对数=4+
| 1 |
| 2 |
| 1 |
| 2 |
故答案为:正四面体形,sp3杂化;
(2)由流程图可知向Cu(NH3)4SO4水溶液中通入SO2时生成白色沉淀,根据所给沉淀的化学式书写离子方程式,所以离子方程式为:2Cu(NH3)42++3SO2+4H2O=2NH4CuSO3↓+6NH4++SO42-;
故答案为:2Cu(NH3)42++3SO2+4H2O=2NH4CuSO3↓+6NH4++SO42-;
(3)①a.氨气极易溶于水,是因为NH3分子和H2O分子之间形成2种不同的氢键,N与H,O与H之间,故a错误;
b.NH3分子和H2O分子,分子空间构型不同,氨气是三角锥型,水是角形,氨气分子的键角大于水分子的键角,故b 错误;
c. Cu(NH3)4SO4所含有的化学键有离子键、极性共价键和配位键,硫酸根离子与配离子之间是离子键,N与H之间是共价键,氨气与铜离子之间是配位键,故c正确;
d. Cu(NH3)4SO4组成元素中电负性最大的是氧元素,故d错误,
故答案为:c;
②根据相似相容原理,极性分子易溶于极性溶剂,乙醇分子极性比水分子极性弱,加入乙醇降低溶剂的极性,从而减小溶质的溶解度;
故答案为:乙醇分子极性比水分子极性弱,加入乙醇降低溶剂的极性,从而减小溶质的溶解度;
(4)Cu晶体的堆积方式是面心立方最密堆积,所以配位数是12;由图可知,立方体的面的对角线长是4r,所以立方体的棱长a=2
| 2 |
| 4 |
| 3 |
| 4 |
| 3 |
4×
| ||
(2
|
故答案为:=
4×
| ||
(2
|
点评:本题考查了物质制备实验方案,物质结构的计算分析,浸提结构的堆积方式和利用率的计算应用,掌握基础是关键,题目难度较简单.

练习册系列答案
相关题目
“纳米技术”广泛地应用于催化及军事科学中,“纳米材料”是指粒子直径在几纳米到几十纳米(nm)之间的材料(1nm=10-9m).如将纳米材料分散到液体分散剂中,所得混合物具有的性质是( )
| A、能全部透过半透膜 |
| B、用激光笔照射有光亮的“通路” |
| C、所得溶液一定能导电 |
| D、所得物质一定为悬浊液或乳浊液 |



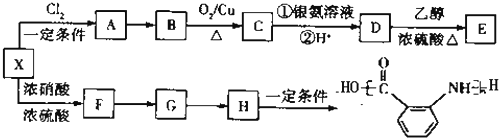
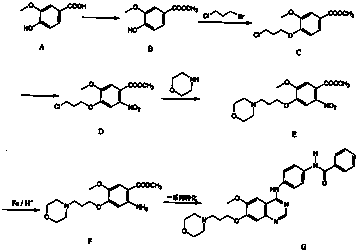
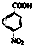 )为原料合成对氨基苯甲酸乙酯(
)为原料合成对氨基苯甲酸乙酯(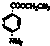 )的合成路线(试剂任选,用合成路线流程图表示)
)的合成路线(试剂任选,用合成路线流程图表示) 实验室制备1,2-二溴乙烷的反应原理如下:CH3CH2OH
实验室制备1,2-二溴乙烷的反应原理如下:CH3CH2OH