题目内容
19.下列离子方程式正确的是( )| A. | 饱和碳酸钠溶液中通入过量二氧化碳气体:CO32-+CO2+H2O═2HCO3- | |
| B. | NaHCO3溶液中滴入偏铝酸钠溶液:HCO3-+AlO2-+H2O═Al(OH)3↓+CO32- | |
| C. | NaHSO3溶液与FeCl3溶液混合溶液颜色变浅:SO32-+2Fe3++H2O═SO42-+2Fe2++2H+ | |
| D. | 向NH4Al(SO4)2溶液中加入Ba(OH)2溶液至SO42-恰好沉淀完全:Al3++2SO42-+2Ba2++4OH-═2BaSO4↓+AlO2-+2H2O |
分析 A.碳酸氢钠的溶解度小于碳酸钠的溶解度;
B.碳酸氢钠与偏铝酸钠反应生成氢氧化铝和碳酸钠;
C.三价铁离子具有强的氧化性,能够氧化亚硫酸氢根离子生成硫酸根离子,本身被还原为二价铁离子;
D.向NH4Al(SO4)2溶液中滴入Ba(OH)2溶液恰好使SO42-完全沉淀,说明SO42-与Ba2+的比例是1:2;
解答 解:A.向饱和碳酸钠溶液中通入足量二氧化碳气体,离子方程式:2Na++CO32-+H2O+CO2=2NaHCO3↓,故A错误;
B.NaHCO3溶液中滴入偏铝酸钠溶液,离子方程式:HCO3-+AlO2-+H2O═Al(OH)3↓+CO32-,故B正确;
C.NaHSO3溶液与FeCl3溶液混合溶液颜色变浅,离子方程式:SO32-+2Fe3++H2O═SO42-+2Fe2++2H+,故C正确;
D.向NH4Al(SO4)2溶液中滴入Ba(OH)2溶液恰好使SO42-完全沉淀,离子方程式为:2Ba2++NH4++Al3++2SO42-+4OH-═Al(OH)3↓+NH3•H2O+2BaSO4↓,故D错误;
故选:BC.
点评 本题考查了离子方程式的书写,明确反应实质及离子方程式书写方法是解题关键,注意离子反应遵循客观事实、遵循原子个数、电荷数守恒规律,注意反应物用量对反应的影响,题目难度不大.

练习册系列答案
 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案
相关题目
5.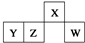 短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示,其中W原子的最外层电子数是最内层电子数的3倍.下列判断正确的是( )
短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示,其中W原子的最外层电子数是最内层电子数的3倍.下列判断正确的是( )
 短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示,其中W原子的最外层电子数是最内层电子数的3倍.下列判断正确的是( )
短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示,其中W原子的最外层电子数是最内层电子数的3倍.下列判断正确的是( )| A. | 原子半径:rW>rZ>rY>rX | |
| B. | 含Y元素的硫酸盐溶液可以和强酸、强碱反应 | |
| C. | 最简单气态氢化物的热稳定性:Z>W | |
| D. | X的氢化物与X的最高价氧化物对应的水化物能形成离子化合物 |
10.NA表示阿伏伽德罗常数,下列说法正确的是( )
| A. | 1mol过氧化钠中阴离子数目为2NA | |
| B. | 1mol氯气与足量的NaOH溶液反应,转移电子的数目为2 NA | |
| C. | 标准状况下,11.2L氨水含有0.5 NA个NH3分子 | |
| D. | 9g水中含有5 NA个电子 |
7.有关常温下pH均为3的酸酸和硫酸的说法正确的是( )
| A. | 分别加水稀释100倍后,两种溶液的pH仍相同 | |
| B. | 醋酸中的c(CH3COO-)和硫酸中的c(SO42-)相等 | |
| C. | 分别加入足量锌片,两种溶液生成H2的体积相同 | |
| D. | 两种溶液中,由水电离出的氢离子浓度均为1×10-11 mol•L-1 |
14.下列有关Na2CO3和NaHCO3的说法不正确的是( )
| A. | 等质量的Na2CO3和NaHCO3分别与足量盐酸反应,NaHCO3产生的CO2多 | |
| B. | 等物质的量的盐酸分别与足量的Na2CO3和NaHCO3反应,Na2CO3产生的CO2多 | |
| C. | 相同温度在水中的溶解度:Na2CO3大于NaHCO3 | |
| D. | 等物质的量的Na2CO3和NaHCO3分别与足量的盐酸反应,消耗盐酸的量一样多 |
4.能正确表示下列反应的离子方程式是( )
| A. | 硫氢化钠的水解反应 HS-+H2O?S2-+H3O+ | |
| B. | 碳酸氢钙与过量的 NaOH 溶液反应 Ca2++2HCO3-+2OH-═CaCO3↓+2H2O+CO32- | |
| C. | Na2O2与H2O反应制备O2 Na2O2+H2O═2Na++2OH-+O2↑ | |
| D. | 向碳酸钠溶液中加少量盐酸 CO32-+2H+═H2O+CO2↑ |
11.一定量的铁粉与足量2mol/L盐酸反应,为了加快反应速率且不影响产生氢气的量,可向溶液中加入( ):
①3mol/L的硝酸溶液
②少量CuSO4(s)
③加入一定量的铜
④少量CH3COONa(s)
⑤对溶液加热(假定盐酸溶质不挥发)
⑥向反应液中通入HCl气体
⑦加入过量铁粉
⑧将铁粉改为铁片.
①3mol/L的硝酸溶液
②少量CuSO4(s)
③加入一定量的铜
④少量CH3COONa(s)
⑤对溶液加热(假定盐酸溶质不挥发)
⑥向反应液中通入HCl气体
⑦加入过量铁粉
⑧将铁粉改为铁片.
| A. | ②③④⑤⑥ | B. | ③⑤⑥ | C. | ①③⑤⑥⑦ | D. | ③⑤⑥⑧ |
8.下列图示与对应的叙述相符的是( )


| A. | 图甲表示可逆反应A(g)+2B(g)?2C(g),速率随外界条件的改变曲线 | |
| B. | 图乙表示CH3COOH溶液中通入NH3至过量的过程中溶液导电性的变化 | |
| C. | 图丙表示用0.1mol/LNaOH溶液滴定20.00mL0.1mol/L醋酸溶液得到的滴定曲线 | |
| D. | 图丁表示等量NO2在容积相同的恒容密闭容器中,不同温度下分别发生反应:2NO2(g)?N2O4(g)相同时间后测得NO2含量的曲线,则该反应的△H<0 |
9. 自然界里氮的固定途径之一是在闪电的作用下,N2与O2反应生成NO.
自然界里氮的固定途径之一是在闪电的作用下,N2与O2反应生成NO.
(1)反应需要在闪电或极高温条件下发生,说明该反应A.(填字母)
A.所需的活化能很高 B.吸收的能量很多
(2)在不同温度下,反应N2(g)+O2(g)?2NO(g)的平衡常数K如下表:
①该反应的△H>0.(填“>”、“=”或“<”)
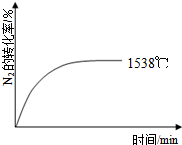
②其他条件相同时,在上述三个温度下分别发生该反应.1538℃时,N2的转化率随时间变化如右图所示,请补充完成1760℃、2404℃时N2的转化率随时间变化的示意图.
(3)一定条件下该反应在密闭容器中达到平衡后,要提高N2的转化率,可以采取的措施是AE.
A.降低温度 B.加催化剂 C.增加压强
D.增加O2浓度 E.分离出一氧化氮
(4)NO在科学界被誉为“明星分子”,用NO与O2反应可以制备NO2,NO2是一种优良的氧化剂.已知火箭发射时可用肼(N2H4)作燃料,NO2作氧化剂,这两者反应生成N2和H2O(气).
且:N2(g)+2O2(g)═2NO2(g)△H=+67.7kJ/mol
N2H4(g)+O2(g)═N2(g)+2H2O(g)△H=-534kJ/mol
请写出肼与NO2反应的热化学方程式2N2H4(g)+2NO2(g)=3N2(g)+4H2O(g)△H=-1135.7KJ/mol.
 自然界里氮的固定途径之一是在闪电的作用下,N2与O2反应生成NO.
自然界里氮的固定途径之一是在闪电的作用下,N2与O2反应生成NO.(1)反应需要在闪电或极高温条件下发生,说明该反应A.(填字母)
A.所需的活化能很高 B.吸收的能量很多
(2)在不同温度下,反应N2(g)+O2(g)?2NO(g)的平衡常数K如下表:
| 温度/℃ | 1538 | 1760 | 2404 |
| 平衡常数K | 0.86×10-4 | 2.6×10-4 | 64×10-4 |
②其他条件相同时,在上述三个温度下分别发生该反应.1538℃时,N2的转化率随时间变化如右图所示,请补充完成1760℃、2404℃时N2的转化率随时间变化的示意图.
(3)一定条件下该反应在密闭容器中达到平衡后,要提高N2的转化率,可以采取的措施是AE.
A.降低温度 B.加催化剂 C.增加压强
D.增加O2浓度 E.分离出一氧化氮
(4)NO在科学界被誉为“明星分子”,用NO与O2反应可以制备NO2,NO2是一种优良的氧化剂.已知火箭发射时可用肼(N2H4)作燃料,NO2作氧化剂,这两者反应生成N2和H2O(气).
且:N2(g)+2O2(g)═2NO2(g)△H=+67.7kJ/mol
N2H4(g)+O2(g)═N2(g)+2H2O(g)△H=-534kJ/mol
请写出肼与NO2反应的热化学方程式2N2H4(g)+2NO2(g)=3N2(g)+4H2O(g)△H=-1135.7KJ/mol.