题目内容
已知反应 Zn+2FeCl3=ZnCl2+2FeCl2能自发发生反应,请根据该反应设计一个原电池.
(1)正极的电极反应式为 ;负极的电极反应式为 .
(2)在下面画出该原电池装置图(要求注明电极材料、电解质溶液):

(1)正极的电极反应式为
(2)在下面画出该原电池装置图(要求注明电极材料、电解质溶液):

考点:原电池和电解池的工作原理
专题:电化学专题
分析:根据反应“Zn+2FeCl3═ZnCl2+2FeCl2”可知,反应中Zn被氧化,应为原电池负极,失电子而被氧化,
正极应为活泼性比Zn弱的金属或非金属材料,Fe3+在正极得到电子而被还原,电解质溶液为FeCl3,以此画出实验装置图并书写有关的电极反应式.
正极应为活泼性比Zn弱的金属或非金属材料,Fe3+在正极得到电子而被还原,电解质溶液为FeCl3,以此画出实验装置图并书写有关的电极反应式.
解答:
解:(1)由反应“Zn+2FeCl3═ZnCl2+2FeCl2”可知,反应中Zn被氧化,应为原电池负极,失电子而被氧化,
电极反应为Zn-2e-=Zn2+,正极应为活泼性比Zn弱的金属或非金属材料,Fe3+在正极得到电子而被还原,
电极反应式为Fe3++e-=Fe2+,
故答案为:Zn-2e-=Zn2+;2Fe3++2e-=2Fe2+;
(2)Zn为负极,C为正极,电解质溶液为FeCl3,实验装置图可设计如下: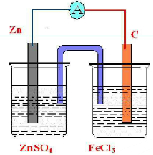 ,
,
故答案为: .
.
电极反应为Zn-2e-=Zn2+,正极应为活泼性比Zn弱的金属或非金属材料,Fe3+在正极得到电子而被还原,
电极反应式为Fe3++e-=Fe2+,
故答案为:Zn-2e-=Zn2+;2Fe3++2e-=2Fe2+;
(2)Zn为负极,C为正极,电解质溶液为FeCl3,实验装置图可设计如下:
 ,
,故答案为:
 .
.
点评:本题考查原电池的设计及原电池的工作原理,侧重于学生的分析能力的考查,难度不大,注意从氧化还原反应的角度由电池反应判断电极反应.

练习册系列答案
相关题目
密闭容器中,反应A(?)+xB(?)?2C(g)达到平衡时,A的浓度为0.5mol.L-1,若保持温度不变,将容器的体积扩大到原来的2倍,达到新平衡时A的浓度降为0.3mol.L-1.下列判断正确的是( )
| A、物质B可能为固态 |
| B、平衡向正反应方向移动 |
| C、B的转化率降低 |
| D、x的值大于等于1 |
某制药厂尾气中含少量SO2气体,一般用NaOH溶液或氨水吸收,以防污染环境.分别用相同PH相同体积的NaOH溶液和氨水处理相同量的尾气,两种方法所需吸收液的体积关系是( )
| A、NaOH溶液的体积大于氨水 |
| B、NaOH溶液的体积等于氨水 |
| C、NaOH溶液的体积小于氨水 |
| D、无法判断 |
等物质的量的SO2、SO3之间的关系正确的是( )
| A、所含氧原子的物质的量的比为1:1 |
| B、所含硫原子的物质的量的比为1:1 |
| C、所含氧原子的质量为1:1 |
| D、SO2和SO3的质量为1:1 |
对于物质的量浓度均为0.01mol?L-1的①NaOH、②Na2CO3、③CH3COOH、④HCl四种溶液,下列说法正确的是( )
| A、②和④等体积混合后的溶液中离子浓度大小为:c(Na+)>c(OH-)>c(HCO3-)>c(H+) | ||||||
B、②升高温度,
| ||||||
| C、pH相同的①和②,物质的量浓度关系:①>② | ||||||
| D、①和③以体积比2:5混合,所得溶液中存在:c(CH3COO-)+c(OH-)=c(Na+)+c(H+) |

 (1)在如图1用石墨作电极的电解池中,放入500mL含一种溶质的某蓝色溶液进行电解,观察到A电极表面有红色的固态物质生成,B电极有无色气体生成;当溶液中的原有溶质完全电解后,停止电解,取出A电极,洗涤、干燥、称量、电极增重1.6g.请回答下列问题:
(1)在如图1用石墨作电极的电解池中,放入500mL含一种溶质的某蓝色溶液进行电解,观察到A电极表面有红色的固态物质生成,B电极有无色气体生成;当溶液中的原有溶质完全电解后,停止电解,取出A电极,洗涤、干燥、称量、电极增重1.6g.请回答下列问题: