题目内容
 在0.2L由NaCl、MgCl2、CaCl2组成的混合液中,部分离子浓度大小如图所示,回答下列问题:
在0.2L由NaCl、MgCl2、CaCl2组成的混合液中,部分离子浓度大小如图所示,回答下列问题:(1)该混合液中含溶质MgCl2的物质的量为
(2)将该混合液加水稀释至体积为1L,稀释后溶液中Ca2+的物质的量浓度为
考点:物质的量浓度的相关计算
专题:计算题
分析:(1)先根据MgCl2的物质的量浓度=镁离子浓度来计算浓度,再根据n=cV计算;
(2)根据稀释前后溶质的物质的量不变,利用C=
来解答.
(2)根据稀释前后溶质的物质的量不变,利用C=
| n |
| V |
解答:
解:(1)根据MgCl2的物质的量浓度=镁离子浓度=0.5 mol?L-1,MgCl2的物质的量=0.5 mol?L-1×0.2L=0.1mol,故答案为:0.1mol;
(2)溶液中的电荷守恒:c(Na+)×1+c(Mg2+)×2+c(Ca2+)×2=c(Cl-)×1,1.0 mol?L-1 +0.5 mol?L-1×2+c(Ca2+)×2=3 mol?L-1×1,c(Ca2+)=0.5 mol?L-1,c(CaCl2)=0.5 mol?L-1,稀释后溶液中Ca2+的物质的量浓度为
=0.1 mol?L-1,故答案为:0.1mol;0.1 mol?L-1.
(2)溶液中的电荷守恒:c(Na+)×1+c(Mg2+)×2+c(Ca2+)×2=c(Cl-)×1,1.0 mol?L-1 +0.5 mol?L-1×2+c(Ca2+)×2=3 mol?L-1×1,c(Ca2+)=0.5 mol?L-1,c(CaCl2)=0.5 mol?L-1,稀释后溶液中Ca2+的物质的量浓度为
| 0.5mol/L×0.2L |
| 1L |
点评:本题主要考查了溶液浓度、物质量的计算,同时还运用了电荷守恒注意稀释前后溶质的物质的量不变是关键,难度不大.

练习册系列答案
相关题目
下列说法正确的是( )
| A、含有离子键和共价键的化合物一定是离子化合物 |
| B、所有元素原子的最外层电子数等于该元素的最高化合价 |
| C、元素的相对原子质量数值上等于该元素的原子序数 |
| D、多电子原子中,在离核较近的区域内运动的电子能量较高 |
下列说法正确的是( )
| A、P和S属于第三周期元素,P原子半径比S大 |
| B、Na和Rb属于第ⅠA族元素,Rb失电子能力比Na强 |
| C、C和Si属于第ⅣA族元素,SiH4比CH4稳定 |
| D、Cl和Br属于第ⅦA族元素,HClO4酸性比HBrO4弱 |
 的系统命名是:
的系统命名是: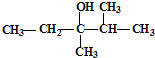 的键线式是
的键线式是 是由一种单体缩聚而成的,该单体的结构简式为
是由一种单体缩聚而成的,该单体的结构简式为 两种气态烃组成的混合气体,完全燃烧后得到CO2和H2O的物质的量与混合烃物质的量的关系如图所示,则下列对混合烃的判断正确的是( )
两种气态烃组成的混合气体,完全燃烧后得到CO2和H2O的物质的量与混合烃物质的量的关系如图所示,则下列对混合烃的判断正确的是( )