题目内容
3.下列试剂不能用于鉴别乙醇和乙酸的是( )| A. | NaHCO3溶液 | B. | 石蕊试液 | C. | NaOH溶液 | D. | CuO |
分析 乙酸含-COOH,乙醇含-OH,结合羧酸、醇的性质来解答.
解答 解:A.乙酸与碳酸氢钠反应生成气体,乙醇不能,可鉴别,故A不选;
B.乙酸遇石蕊变红,乙醇不能,可鉴别,故B不选;
C.乙酸与NaOH反应现象不明显,乙醇不反应,不能鉴别,故C选;
D.乙酸与CuO反应生成蓝色溶液,乙醇不能,可鉴别,故D不选;
故选C.
点评 本题考查有机物的鉴别,为高频考点,把握官能团与性质、有机反应为解答的关键,侧重分析与应用能力的考查,注意有机物性质的差异,题目难度不大.

练习册系列答案
相关题目
13.某学习小组通过下列装置探究MnO2与FeCl3•6H2O能否反应产生Cl2.
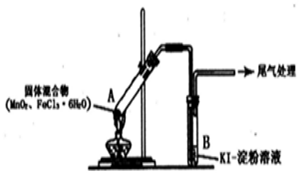
实验操作和现象如表:
回答下列问题:
(l)上述实验中的白雾是盐酸小液滴;试管A管口向上倾斜的原因是试管A中部分固体溶解在FeCl3•6H2O分解生成的水中形应溶液
(2)实验2说明黄色气体中含有FeCl3,写出FeCl3使KI一淀粉溶液变蓝的离子方程式:2Fe3++2I-=2Fe2++I2
(3)为进一步确认黄色气体中含有Cl2,该学习小组对实验1提出两种改进方案:
方案1:在A、B间增加盛有某种试剂的洗气瓶C,结果B中溶液仍变为蓝色.
方案2:将B中KI一淀粉溶液替换为NaBr溶液,结果B中溶液呈橙红色,且未检出Fe2+.则方案1C中盛放的试剂是饱和NaCl溶液;方案2中检验Fe2+的试剂是铁氰化钾溶液,选择NaBr溶液的依据是Br-可以被Cl2氧化成Br2,但不会被Fe3+氧化为Br2.
(4)实验1充分加热后,若反应中被氧化与未被氧化的氯元素质量之比为1:2,则A中发生反应的化学方程式为MnO2+2FeCl3•6H2O$\frac{\underline{\;\;△\;\;}}{\;}$Fe2O3+MnCl2+Cl2↑+2HCl+11H2O;其尾气处理的方法是将尾气通入到氢氧化钾溶液中.
(5)该学习小组认为实验1 中溶液变蓝,可能还有另外一种原因是:实验未先赶出空气,其中的O2在此条件下可能氧化I-.请你设计实验方案验证此猜想:向一试管中加入KI-淀粉溶液.再滴入几滴稀盐酸,在空气中放置,观察一段时间后溶液是否变蓝.

实验操作和现象如表:
| 实验编号 | 操作 | 现象 |
| 实验1 | 按上图所示加热MnO2与FeCl3•6H2O 混合物 | ①试管A中部分固体溶解,上方出现白雾 ②稍后,产生黄色气体,管壁附着黄色液滴 ③试管B中溶液变蓝 |
| 实验2 | 把A中的混合物换为FeC13•6H2O,B中溶液换为KSCN溶液,加热. | A中部分固体溶解,产生白雾和黄色气体,B中KSCN溶液变红 |
(l)上述实验中的白雾是盐酸小液滴;试管A管口向上倾斜的原因是试管A中部分固体溶解在FeCl3•6H2O分解生成的水中形应溶液
(2)实验2说明黄色气体中含有FeCl3,写出FeCl3使KI一淀粉溶液变蓝的离子方程式:2Fe3++2I-=2Fe2++I2
(3)为进一步确认黄色气体中含有Cl2,该学习小组对实验1提出两种改进方案:
方案1:在A、B间增加盛有某种试剂的洗气瓶C,结果B中溶液仍变为蓝色.
方案2:将B中KI一淀粉溶液替换为NaBr溶液,结果B中溶液呈橙红色,且未检出Fe2+.则方案1C中盛放的试剂是饱和NaCl溶液;方案2中检验Fe2+的试剂是铁氰化钾溶液,选择NaBr溶液的依据是Br-可以被Cl2氧化成Br2,但不会被Fe3+氧化为Br2.
(4)实验1充分加热后,若反应中被氧化与未被氧化的氯元素质量之比为1:2,则A中发生反应的化学方程式为MnO2+2FeCl3•6H2O$\frac{\underline{\;\;△\;\;}}{\;}$Fe2O3+MnCl2+Cl2↑+2HCl+11H2O;其尾气处理的方法是将尾气通入到氢氧化钾溶液中.
(5)该学习小组认为实验1 中溶液变蓝,可能还有另外一种原因是:实验未先赶出空气,其中的O2在此条件下可能氧化I-.请你设计实验方案验证此猜想:向一试管中加入KI-淀粉溶液.再滴入几滴稀盐酸,在空气中放置,观察一段时间后溶液是否变蓝.
14.下列物质中,不能通过化合反应制取的是( )
| A. | FeCl2 | B. | H2SiO3 | C. | CaSiO3 | D. | Cu2(OH)2CO3 |
18.下列有关实验的锚述正确的是( )
| A. | 向碘化钠溶液中加入新制氯水可看到有紫黑色固体生成 | |
| B. | 向分别装有1gNa2CO3和NaHCO3固体的试管中滴入几滴水,温度高的为Na2CO3 | |
| C. | 将Fe(NO3)2样品溶于稀硫酸后,滴加KSCN溶液,变红,说明样品变质 | |
| D. | 中和热测定时环形玻璃搅拌棒要不断顺时针搅拌,目的是为了混合均匀,充分反应 |
3. 某校化学小组用实验的方法进行探究影响化学反应速率的因素.
某校化学小组用实验的方法进行探究影响化学反应速率的因素.
他们只利用Cu、Fe、Al和不同浓度的硫酸(0.5 mol•L-1、2 mol•L-1、18.4 mol•L-1).设计实验方案来研究影响反应速率的因素.甲同学研究的实验报告如下表:常温下,
(1)甲同学表中实验步骤②为分别投入大小、形状相同的Cu、Fe、Al
(2)甲同学的实验目的是研究金属(或反应物)本身的性质与反应速率的关系
(3)乙同学为了更精确的研究浓度对反应速率的影响,利用如图所示装置进行定量实验.乙同学在实验中应该测定的数据是测定一定时间内产生气体的体积(或产生一定体积的气体所需时间)
(4)乙同学完成该实验应选用的实验药品是Fe(或Al)、0.5 mol•L-1硫酸和2 mol•L-1硫酸;该实验中不选用某浓度的硫酸,理由是常温下Fe(或Al)在18.4 mol•L-1硫酸中钝化.
 某校化学小组用实验的方法进行探究影响化学反应速率的因素.
某校化学小组用实验的方法进行探究影响化学反应速率的因素.他们只利用Cu、Fe、Al和不同浓度的硫酸(0.5 mol•L-1、2 mol•L-1、18.4 mol•L-1).设计实验方案来研究影响反应速率的因素.甲同学研究的实验报告如下表:常温下,
| 实验步骤 | 现象 | 结论 |
| ①分别取等体积的2mol/L-1硫酸于试管中; ②分别投入大小、形状相同的Cu、Fe、Al. | 反应速率:Al>Fe,Cu不反应 | 金属的性质越活泼,反应速率越快. |
(2)甲同学的实验目的是研究金属(或反应物)本身的性质与反应速率的关系
(3)乙同学为了更精确的研究浓度对反应速率的影响,利用如图所示装置进行定量实验.乙同学在实验中应该测定的数据是测定一定时间内产生气体的体积(或产生一定体积的气体所需时间)
(4)乙同学完成该实验应选用的实验药品是Fe(或Al)、0.5 mol•L-1硫酸和2 mol•L-1硫酸;该实验中不选用某浓度的硫酸,理由是常温下Fe(或Al)在18.4 mol•L-1硫酸中钝化.
10.实验室需用2mol•L-1氯化钠溶液800mL,配置时应选用容量瓶的规格和称取氯化钠的质量分别是( )
| A. | 800 mL,93.6 g | B. | 1000 mL,93.6 g | C. | 1 000 mL,117 g | D. | 800mL,117 g |
7.下列说法正确的是( )
| A. | 电解精炼铜时,同一时间内阳极溶解的铜的质量比阴极析出的铜的质量小 | |
| B. | 在镀件上电镀锌,可以用锌做阳极,也可以用惰性材料做阳极 | |
| C. | 二次电池充电过程是化学能转化为电能的过程 | |
| D. | 二次电池充电时,电池上标有“+”的电极应与外接电源的负极相连 |
8.下列离子方程式正确的是( )
| A. | 氢氧化钠溶液中通入足量二氧化硫:SO2+2OH-═SO32-+2H2O | |
| B. | 石灰石与醋酸反应:CaCO3+2H+═Ca2++H2O+CO2↑ | |
| C. | 钠与水反应:2Na+2H2O=2Na++2OH-+H2↑ | |
| D. | 酸性氯化亚铁溶液中加入双氧水2Fe2++H2O2═2Fe3++O2↑+2H+ |
