题目内容
4.下列说法正确的是( )| A. | 甲烷的标准燃烧热为△H=-890.3kJ•mol-1,则甲烷燃烧的热化学方程式可表示为CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-890.3 kJ•mol-1 | |
| B. | 500℃、30MPa下,将0.5mol N2和1.5molH2置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为 N2(g)+3H2(g)?2NH3(g)△H=-38.6kJ•mol-1 | |
| C. | 常温常压下,酸与碱反应生成1mol水时所放出的热量一定为57.3KJ | |
| D. | 放热反应的△H一定比吸热反应小 |
分析 A.燃烧热中水为液态;
B.合成氨为可逆反应,热化学方程式中为完全转化时的能量变化;
C.生成沉淀或浓溶液稀释放热,弱电解质的电离吸热;
D.吸热反应的△H>0,放热反应的△H<0.
解答 解:A.甲烷的标准燃烧热为△H=-890.3kJ•mol-1,则甲烷燃烧的热化学方程式可表示为CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-890.3 kJ•mol-1,故A错误;
B.500℃、30MPa下,将0.5mol N2和1.5molH2置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,则1molN2和3molH2完全反应生成NH3(g),放热大于38.6.3kJ,其热化学方程式为 N2(g)+3H2(g)?2NH3(g)△H<-38.6kJ•mol-1,故B错误;
C.常温常压下,稀的强酸与强碱反应生成1mol水及可溶性盐时所放出的热量为57.3KJ,则常温常压下,酸与碱反应生成1mol水时所放出的热量不一定为57.3KJ,故C错误;
D.吸热反应的△H>0,放热反应的△H<0,则放热反应的△H一定比吸热反应小,故D正确;
故选D.
点评 本题考查反应热与焓变,为高频考点,把握燃烧热、中和反应、热化学方程式为解答的关键,侧重分析与应用能力的考查,注意焓变与热量的关系,题目难度不大.

练习册系列答案
 小学教材全测系列答案
小学教材全测系列答案 小学数学口算题卡脱口而出系列答案
小学数学口算题卡脱口而出系列答案 优秀生应用题卡口算天天练系列答案
优秀生应用题卡口算天天练系列答案
相关题目
14.下列指定反应的离子方程式正确的是( )
| A. | 向FeCl3溶液中滴加HI溶液:Fe3++2I-═Fe2++I2 | |
| B. | 用铜电极电解氯化钠溶液:2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$Cl2↑+H2↑+2OH- | |
| C. | 向Al2(SO4)3溶液中加入过量氨水:Al3++3NH3•H2O═Al(OH)3↓+3NH4+ | |
| D. | 向Na2SiO3溶液中滴加稀盐酸:Na2SiO3+2H+═H2SiO3↓+2 Na+ |
15.下列有关二氧化硫的说法正确的是( )
| A. | 密度比空气小 | |
| B. | 是无色无味的气体 | |
| C. | SO2能使溴水褪色,说明SO2具有漂白性 | |
| D. | 某生产硫酸厂区紫罗兰花变成白色,说明其周围空气中可能含较高浓度SO2 |
12.下列有关实验原理或实验操作正确的是( )
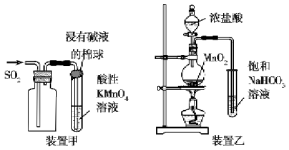

| A. | 装置甲收集SO2并验证其漂白性 | |
| B. | 装置乙验证氯气与水反应有盐酸生成 | |
| C. | 为河定新制氯水的pH,用玻璃棒蘸取液体滴在pH试纸上,与标准比色卡对照 | |
| D. | 证明Fe3-的氧化性大于Ⅰ2将KI溶液和FeCl3溶液在试管中混合后,加入CCl4,振荡、静置,下层溶液显紫红色 |
19.下列有关纯碱和小苏打的叙述中正确的是( )
| A. | Na2CO3和NaHCO3都既能与酸反应,又能与氢氧化钠溶液反应 | |
| B. | 等质量Na2CO3、NaHCO3分别与相同浓度的盐酸反应,NaHCO3消耗的盐酸体积少 | |
| C. | 向NaHCO3溶液中滴入Ba(OH)2溶液无沉淀,而Na2CO3溶液中加入Ba(OH)2溶液出现白色沉淀 | |
| D. | 等物质的量Na2CO3、NaHCO3分别与足量稀H2SO4反应,NaHCO3产生的CO2多 |
9.化学与生活、环境密切相关,下列说法正确的是( )
| A. | 可以用淀粉检验加碘食盐中是否含有碘元素 | |
| B. | 适量饮酒对身体有利的原因是酒精不能使蛋白质变性 | |
| C. | PM2.5亦称可入肺颗粒物,表面积大,能吸附有毒有害物质 | |
| D. | 使用生物酶降解生活污水中的有机物,可以防止水体富营养化 |
16. 世界上最小的纳米发动机比盐粒小500倍,它由微型铜箔电池供电,放入Br2的稀溶液中(Br2+H2O=H++Br-+HBrO)铜铂电池开始工作,整个纳米发动机会朝着铜电极所指的方向运动,如下图所示.下列说法正确的是( )
世界上最小的纳米发动机比盐粒小500倍,它由微型铜箔电池供电,放入Br2的稀溶液中(Br2+H2O=H++Br-+HBrO)铜铂电池开始工作,整个纳米发动机会朝着铜电极所指的方向运动,如下图所示.下列说法正确的是( )
 世界上最小的纳米发动机比盐粒小500倍,它由微型铜箔电池供电,放入Br2的稀溶液中(Br2+H2O=H++Br-+HBrO)铜铂电池开始工作,整个纳米发动机会朝着铜电极所指的方向运动,如下图所示.下列说法正确的是( )
世界上最小的纳米发动机比盐粒小500倍,它由微型铜箔电池供电,放入Br2的稀溶液中(Br2+H2O=H++Br-+HBrO)铜铂电池开始工作,整个纳米发动机会朝着铜电极所指的方向运动,如下图所示.下列说法正确的是( )| A. | 铂电极未电池的负极 | |
| B. | 铜电极表面有气泡产生 | |
| C. | 铂电极的电极反应式为HBrO+H++2e-=Br-+H2O | |
| D. | 电池工作时实现机械能→电能→化学能的转化 |
17.由于合金的说法不正确的是( )
| A. | 合金是由两种金属或两种非金属熔合而成的物质 | |
| B. | 合金的硬度较大,多数的合金的熔点比各成分的金属的低 | |
| C. | 根据所添加的元素的种类、含量来调节合金的性能 | |
| D. | 不锈钢在大气中比较稳定,不容易生锈,具有很强的抗腐蚀能力 |
18.一定温度、容器体积不变的情况下,发生反应H2(g)+I2(g)?2HI(g),下列选项中不能作为达平衡标志的是( )
| A. | 混合气体颜色不再变化 | B. | 容器内压强不再变化 | ||
| C. | HI的体积分数不再变化 | D. | 2v正(H2)=v逆(HI) |