题目内容
3.在如图所示的装置中,用NaOH溶液、铁屑、稀H2SO4等试剂制备Fe(OH)2.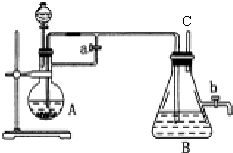
(1)装置A中分液漏斗装的试剂是稀H2SO4;装置B中的试剂加入前应如何处理:煮沸.
(2)实验开始时应先将活塞a打开;活塞b关闭(填“打开”或“关闭”.)
(3)为了制得Fe(OH)2沉淀,在装置A和B中加入试剂后的实验步骤为检查B装置的C出口处排出的氢气纯度,当排出的氢气纯净时,关闭活塞a.
(4)这样生成的Fe(OH)2沉淀能较长时间保持白色,其理由是装置A中反应生成的氢气充满了装置A和装置B,且外界空气不容易进入.
(5)实验完毕,打开b处活塞,放入一部分空气,此时B瓶观察到的现象是白色沉淀迅速变成灰绿色,最后变成红褐色;发生的化学反应为4Fe(OH)2+2H2O+O2═4Fe(OH)3.
分析 (1)根据图示可知装置A用于制备硫酸亚铁,分液漏斗中盛放为稀H2SO4;B装置的溶液中混有氧气,需要通过煮沸赶出;
(2)制备氢氧化亚铁前需要先用氢气排净装置中空气;
(3)通过检验氢气的纯度判断装置中空气是否排净;
(4)根据装置中氢氧化亚铁不易与氧气接触角度分析;
(5)氢氧化亚铁遇到空气迅速被氧化呈氢氧化铁,白色沉淀变为灰绿色.
解答 解:(1)根据图示可知,装置A用于制备硫酸亚铁,所以分液漏斗中盛放为稀H2SO4;为了避免溶液氧气氧化生成的氢氧化亚铁,则需要对装置B中的溶液在加入前应煮沸,排净氧气,
故答案为:稀H2SO4;煮沸;
(2)实验开始时,应先打开活塞a、关闭b,使生成的氢气进入整套实验装置中而排出空气,防止氢氧化亚铁被氧化,
故答案为:打开;关闭;
(3)为了制得Fe(OH)2沉淀,在装置A和B中加入试剂后,需要通过检验氢气纯度判断装置中空气是否被完全排出,方法为:检查B装置的C出口处排出的氢气纯度,当排出的氢气纯净时,说明装置中空气已经排净,可关闭活塞a,
故答案为:检查B装置的C出口处排出的氢气纯度,当排出的氢气纯净时,关闭活塞a;
(4)由于装置A反应生成的氢气充满了装置A和装置B,且外界空气不容易进入,所以氢氧化亚铁不会被氧气氧化,从而Fe(OH)2沉淀能较长时间保持白色,
故答案为:装置A中反应生成的氢气充满了装置A和装置B,且外界空气不容易进入;
(5)打开b处活塞,放入一部分空气,氢氧化亚铁在空气被氧化成氢氧化铁,会看到白色沉淀迅速变成灰绿色,最后变成红褐色,反应的化学方程式是为:4Fe(OH)2+2H2O+O2═4Fe(OH)3,
故答案为:白色沉淀迅速变成灰绿色,最后变成红褐色;4Fe(OH)2+2H2O+O2═4Fe(OH)3.
点评 本题考查了氢氧化亚铁的制备方法,题目难度中等,明确实验目的及发生反应原理为解答关键,注意熟练掌握氢氧化亚铁的制备方法,试题培养了学生的分析能力及化学实验能力.

 名师导航单元期末冲刺100分系列答案
名师导航单元期末冲刺100分系列答案 名校名卷单元同步训练测试题系列答案
名校名卷单元同步训练测试题系列答案| A. |  | B. |  | C. |  | D. |  |
| A. | 铝制容器可以贮运浓硝酸 | B. | 甲醛可用作浸制标本 | ||
| C. | 碳酸氢钠可用来治疗胃酸过多 | D. | 明矾可用作消毒剂 |
| A. | 将40g NaOH溶解在1L水中 | |
| B. | 将25g 胆矾溶于水配成100mL CuSO4溶液 | |
| C. | 将0.1L 10 mol•L-1浓硫酸加入0.9L水中 | |
| D. | 将22.4L HCl气体溶于水配成1L溶液 |
| A. | FeSO4、Fe(NO3)3; Fe2(SO4)3、HNO3、N2O、H2O | |
| B. | HNO3、FeSO4; Fe2(SO4)3、Fe(NO3)3、N2O、H2O | |
| C. | HNO3、Fe2(SO4)3; FeSO4、Fe(NO3)3、N2O、H2O | |
| D. | Fe2(SO4)3、N2O; FeSO4、HNO3、Fe(NO3)3、H2O |
| A. | 明矾净水 | B. | 工业固氮 | C. | 海水提镁 | D. | 电池充电 |
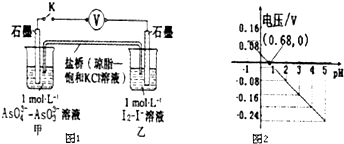
| A. | 调节pH可以改变反应的方向 | |
| B. | pH=0.68 时,反应处于平衡状态 | |
| C. | pH=5 时,负极电极反应式为2I--2e-═I2 | |
| D. | pH>0.68时,氧化性I2>AsO${\;}_{4}^{3-}$ |
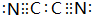 .
.