题目内容
常温下将0.1mol/L的HCl和0.06mol/L的Ba(OH)2等体积混合,求所得溶液的PH值.
考点:pH的简单计算
专题:电离平衡与溶液的pH专题
分析:先计算出氢离子、氢氧根离子浓度,然后根据等体积混合后酸碱过量情况计算出反应后的溶液中氢离子浓度,最后根据溶液pH的表达式计算出溶液的pH.
解答:
解:0.1mol?L-1盐酸溶液中氢离子浓度为:c(H+)=0.1mol/L,
0.06mol?L-1氢氧化钡溶液中氢氧根离子浓度为:c(OH-)=2c(Ba(OH)2)=0.12mol/L,
两溶液等体积混合后氢氧根离子过量,设溶液体积为VL,
则反应后溶液中氢氧根离子浓度为:c(OH-)=
=0.01mol/L,
溶液中氢离子浓度为:c(H+)=
=1×10-12mol/L,
混合液的pH为:pH=-lgc(H+)=12,
答:所得溶液的pH=12.
0.06mol?L-1氢氧化钡溶液中氢氧根离子浓度为:c(OH-)=2c(Ba(OH)2)=0.12mol/L,
两溶液等体积混合后氢氧根离子过量,设溶液体积为VL,
则反应后溶液中氢氧根离子浓度为:c(OH-)=
| 0.12mol/L×VL-0.1mol/L |
| 2V |
溶液中氢离子浓度为:c(H+)=
| 1×10-14 |
| 0.01 |
混合液的pH为:pH=-lgc(H+)=12,
答:所得溶液的pH=12.
点评:本题考查酸碱混合液pH的计算,题目难度不大,试题侧重基础知识的考查,注意酸碱物质的量的计算和过量问题,把握好溶液酸碱性与溶液pH的计算公式.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
可以用分液漏斗分离的一组液体混合物是( )
| A、溴和四氯化碳 |
| B、苯和溴苯 |
| C、乙醇和乙酸 |
| D、水和四氯化碳 |
在4NH3+5O2?4NO+6H2O反应中,表示该反应速率最快的是( )
| A、υ(NH3)=0.8mol/(L?s) |
| B、υ(O2)=1.0mol/(L?s) |
| C、υ(NO)=1.0mol/(L?s) |
| D、υ(H2O)=1.8mol/(L?s) |
下表中的数据是破坏1mol物质中的化学键所消耗的能量(kJ):
根据上述数据回答下列物质本身具有的能量最低的是( )
| 物质 | Cl2 | Br2 | I2 | HCl | HBr | HI | H2 |
| 能量(kJ) | 243 | 193 | 151 | 432 | 366 | 298 | 436 |
| A、Cl2 |
| B、Br2 |
| C、I2 |
| D、H2 |
120℃、101kPa,甲烷(CH4)和过量的O2的混合物,用电火花引燃(CH4+2O2=CO2+2H2O)后,恢复到原来的温度和压强,测得反应后气体密度为相同条件下H2密度的15倍,则原混合气体中甲烷和氧气的体积比为( )
| A、9:1 | B、1:9 |
| C、1:7 | D、7:1 |
设NA为阿伏伽德罗常数的值,下列叙述正确的是( )
| A、1 L 0.1mol?L-1的氨水含有0.1NA个OH- |
| B、23g NO2和N2O4的混合气体中含有氮原子数为0.5NA |
| C、25℃时,pH=13的Ba(OH)2溶液中含有OH-的数目为0.1 NA |
| D、在高温高压下,28 gN2和6g H2充分反应生成NH3的分子数为2NA |
用NA代表阿伏加德罗常数,下列说法正确的是( )
| A、25℃和101KPa的条件下,4.9LCH4完全燃烧生成的H2O的分子数为0.4NA |
| B、1molNH3中含有3NA对电子对 |
| C、Na2O2与H2O反应生成标准状况下11.2 L O2时,转移的电子数为2NA |
| D、标准状况下,2.24L HF中所含电子数为NA |
下列化学用语和描述均正确的是( )
A、结构示意图为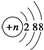 的阴离子都不能破坏水的电离平衡 的阴离子都不能破坏水的电离平衡 | ||
B、球棍模型为: 的分子可发生加成反应 的分子可发生加成反应 | ||
C、符号为
| ||
D、电子式分别为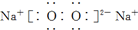 和 和 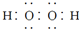 的两种化合物均为常见的氧化剂 的两种化合物均为常见的氧化剂 |