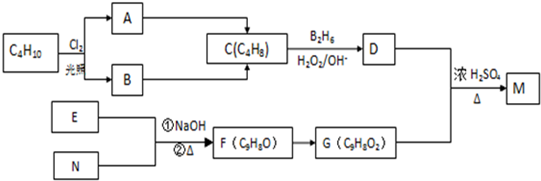
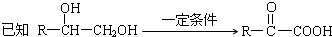
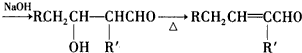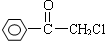题目内容
某实验室需要配制240mL 0.2mol?L-1 的Na2CO3溶液,回答下列问题:
(1)需称量Na2CO3?10H2O的质量 g.
(2)配制时各步骤操作如下,其正确的操作顺序是(用字母表示,每个字母只能用一次) .
A.用30mL水洗涤烧杯和玻璃棒2~3次,洗涤液均注入容量瓶,震荡
B.用称取所需Na2CO3?10H2O 固体的质量,放烧杯中,再加入适量的水,用玻璃棒慢慢搅动,使其完全溶解
C.将已冷却的溶液沿玻璃棒注入250mL的容量瓶中
D.将容量瓶盖紧,振荡,摇匀
E.改用胶头滴管加水,使溶液凹液面恰好与刻度线相切
F.继续往容量瓶内小心加水,直到液面接近刻度线1-2cm处
(3)下列操作会使所配溶液浓度偏高的是 .
A.所选用的溶质已经变质,部分的失去了结晶水
B.转移前,容量瓶中含有少量蒸馏水
C.将未冷却的溶液沿玻璃棒注入容量瓶中
D.定容时,仰视刻度线
E.称量时误操作为“左码右物”
F.定容后使溶液混匀,静止,发现凹液面低于刻度线,立即滴蒸馏水至刻度线
(4)取所配制的碳酸钠溶液125mL,向其加入125mL 0.3mol?L-1 的硫酸溶液,待充分反应后,生成的气体在标准状况下所占的体积为(假设产生的气体全部逸出) ;设反应后溶液的体积为250mL,则反应后溶液中Na+的物质的量浓度为 .
(1)需称量Na2CO3?10H2O的质量
(2)配制时各步骤操作如下,其正确的操作顺序是(用字母表示,每个字母只能用一次)
A.用30mL水洗涤烧杯和玻璃棒2~3次,洗涤液均注入容量瓶,震荡
B.用称取所需Na2CO3?10H2O 固体的质量,放烧杯中,再加入适量的水,用玻璃棒慢慢搅动,使其完全溶解
C.将已冷却的溶液沿玻璃棒注入250mL的容量瓶中
D.将容量瓶盖紧,振荡,摇匀
E.改用胶头滴管加水,使溶液凹液面恰好与刻度线相切
F.继续往容量瓶内小心加水,直到液面接近刻度线1-2cm处
(3)下列操作会使所配溶液浓度偏高的是
A.所选用的溶质已经变质,部分的失去了结晶水
B.转移前,容量瓶中含有少量蒸馏水
C.将未冷却的溶液沿玻璃棒注入容量瓶中
D.定容时,仰视刻度线
E.称量时误操作为“左码右物”
F.定容后使溶液混匀,静止,发现凹液面低于刻度线,立即滴蒸馏水至刻度线
(4)取所配制的碳酸钠溶液125mL,向其加入125mL 0.3mol?L-1 的硫酸溶液,待充分反应后,生成的气体在标准状况下所占的体积为(假设产生的气体全部逸出)
考点:配制一定物质的量浓度的溶液
专题:
分析:(1)根据n=cv计算溶质Na2CO3的物质的量,利用Na2CO3?10H2O的物质的量等于Na2CO3的物质的量,根据m=nM计算Na2CO3?10H2O的质量;
(2)根据配制步骤是计算、称量、溶解、冷却、移液、洗涤、定容、摇匀、装瓶来对操作顺序进行排序;
(3)根据c=
并结合溶质的物质的量n和溶液的体积V的变化来进行误差分析;
(4)硫酸过量,碳酸钠完全反应生成二氧化碳,根据n=cV计算碳酸钠的物质的量,根据碳原子守恒计算二氧化碳的物质的量,再根据V=nVm计算二氧化碳的体积;根据c=
计算反应后钠离子的浓度.
(2)根据配制步骤是计算、称量、溶解、冷却、移液、洗涤、定容、摇匀、装瓶来对操作顺序进行排序;
(3)根据c=
| n |
| V |
(4)硫酸过量,碳酸钠完全反应生成二氧化碳,根据n=cV计算碳酸钠的物质的量,根据碳原子守恒计算二氧化碳的物质的量,再根据V=nVm计算二氧化碳的体积;根据c=
| n |
| V |
解答:
解:(1)因配制溶液的体积为240ml,而容量瓶的规格没有240ml,只能选用250ml,Na2CO3的物质的量n=cV=0.25L×0.2mol?L-1=0.05mol,Na2CO3?10H2O的物质的量等于Na2CO3的物质的量,所以Na2CO3?10H2O的质量0.05mol×286g/mol=14.3g,故答案为:14.3;
(2)根据配制步骤是计算、称量、溶解、冷却、移液、洗涤、定容、摇匀、装瓶可知正确的操作顺序是:BCAFED,故答案为:BCAFED;
(3)A.Na2CO3?10H2O已失去部分结晶水,溶质的质量偏大,浓度偏大,故A选;
B.若容量瓶未干燥即用来配制溶液,对溶液浓度无影响,因为只要定容时正确,至于水是原来就有的还是后来加入的,对浓度无影响,故B不选;
C.将未冷却的溶液沿玻璃棒注入容量瓶中,则冷却后溶液体积偏小,则浓度偏高,故C选;
D.定容时,仰视刻度线,则导致溶液体积偏大,故浓度偏低,故D不选;
E.称量时误操作为“左码右物”时,m物=m砝-m游,会导致溶质的质量偏小,则浓度偏低,故E不选;
F.定容后使溶液混匀,静止,发现凹液面低于刻度线是正常的,立即滴蒸馏水至刻度线会导致浓度偏低,故F不选.
故选AC;
(4)125mL 0.2mol/LNa2CO3溶液中碳酸钠的物质的量=0.125L×0.2mol/L=0.025mol,125mL 0.3mol?L-1 的硫酸溶液中硫酸的物质的量=0.125L×0.3mol/L=0.0375mol,故硫酸过量,碳酸钠完全反应生成二氧化碳,由碳原子守恒可知二氧化碳的物质的量为0.025mol,体积为0.025mol×22.4L/mol=0.56L,
反应后溶液中钠离子物质的量不变,为0.025mol×2=0.05mol,故钠离子的物质的量浓度
=0.2mol/L,
故答案为:0.56L;0.2mol/L.
(2)根据配制步骤是计算、称量、溶解、冷却、移液、洗涤、定容、摇匀、装瓶可知正确的操作顺序是:BCAFED,故答案为:BCAFED;
(3)A.Na2CO3?10H2O已失去部分结晶水,溶质的质量偏大,浓度偏大,故A选;
B.若容量瓶未干燥即用来配制溶液,对溶液浓度无影响,因为只要定容时正确,至于水是原来就有的还是后来加入的,对浓度无影响,故B不选;
C.将未冷却的溶液沿玻璃棒注入容量瓶中,则冷却后溶液体积偏小,则浓度偏高,故C选;
D.定容时,仰视刻度线,则导致溶液体积偏大,故浓度偏低,故D不选;
E.称量时误操作为“左码右物”时,m物=m砝-m游,会导致溶质的质量偏小,则浓度偏低,故E不选;
F.定容后使溶液混匀,静止,发现凹液面低于刻度线是正常的,立即滴蒸馏水至刻度线会导致浓度偏低,故F不选.
故选AC;
(4)125mL 0.2mol/LNa2CO3溶液中碳酸钠的物质的量=0.125L×0.2mol/L=0.025mol,125mL 0.3mol?L-1 的硫酸溶液中硫酸的物质的量=0.125L×0.3mol/L=0.0375mol,故硫酸过量,碳酸钠完全反应生成二氧化碳,由碳原子守恒可知二氧化碳的物质的量为0.025mol,体积为0.025mol×22.4L/mol=0.56L,
反应后溶液中钠离子物质的量不变,为0.025mol×2=0.05mol,故钠离子的物质的量浓度
| 0.05mol |
| 0.26L |
故答案为:0.56L;0.2mol/L.
点评:本题考查了一定物质的量浓度溶液的配制过程中的计算和误差分析,属于基础型题目,难度不大.

练习册系列答案
相关题目
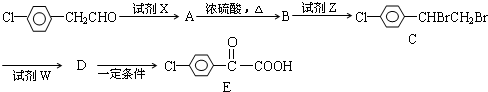
2-氯丙烷跟氢氧化钠的醇溶液共热后,生成的产物再与溴水反应,得到的产物的同分异构体有( )
| A、2种 | B、4种 | C、3种 | D、5种 |
铜板上铁铆钉处的吸氧腐蚀原理如图所示,下列有关说法中,不正确的是( )
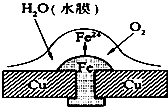

| A、此过程中还涉及到反应:4Fe(OH)2+2H2O+O2=4Fe(OH)3 |
| B、此过程中铜并不被腐蚀 |
| C、此过程中电子从Fe移向Cu |
| D、正极电极反应式为:2H++2e-=H2↑ |
A是由导热材料制成的密闭容器,B是一耐化学腐蚀且易于传热的透明气球.关闭K2,将等量且少量的NO2通过K1、K3分别充入A、B中,反应起始时,A、B的体积相同.(已知:2NO2═N2O4△H<0)下列叙述正确的是( )
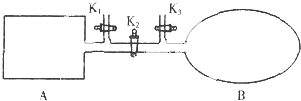

| A、到达平衡时A和B中NO2气体体积分数相同 |
| B、若在A、B中再充入与初始量相等的NO2,则达到平衡时A、B中NO2转化率都增大 |
| C、若气球的体积不再改变,表明B中反应已达到平衡 |
| D、室温下,若设法使A、B都保持体积不变,将A套上一个绝热层,B与外界可以进行热传递,则达到平衡时B中气体的颜色较深 |
实验室制取下列气体时,必须用排水法收集的是( )
| A、NO |
| B、SO2 |
| C、NH3 |
| D、Cl2 |
造成硫酸型酸雨的主要物质是( )
| A、NO2 |
| B、SO2 |
| C、CF2Cl2 |
| D、CO |