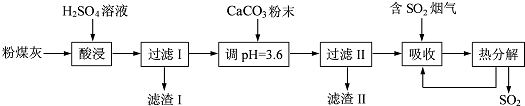
题目内容
有可逆反应Fe(s)+CO2(g)?FeO(s)+CO(g),已知在温度938K时,平衡常数K=1.5,在1173K时,K=2.2.
(1)能判断该反应达到平衡状态的依据是 (双选,填序号).
A.容器内压强不变了
B.c(CO)不变了
C.v正(CO2)=v逆(CO)
D.c(CO2)=c(CO)
(2)该反应的△H 0(填“<”、“>”、“=”).
(3)写出该反应的平衡常数表达式 .若起始时把Fe和CO2放入体积固定的密闭容器中,CO2的起始浓度为2.0mol/L,某温度时达到平衡,此时容器中CO的浓度为1.0mol/L,则该温度下上述反应的平衡常数K= (保留二位有效数字).
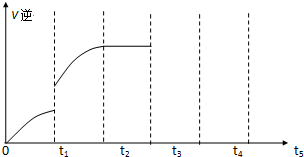
(4)该反应的逆反应速率随时间变化的关系如图:
①从图中看到,反应在t2时达平衡,在t1时改变了某种条件,改变的条件可能是(填序号) .(单选) A.升温 B.增大CO2浓度
②如果在t3时从混合物中分离出部分CO,t4~t5时间段反应处于新平衡状态,请在图上画出t3~t5的V(逆)变化曲线.
(1)能判断该反应达到平衡状态的依据是
A.容器内压强不变了
B.c(CO)不变了
C.v正(CO2)=v逆(CO)
D.c(CO2)=c(CO)
(2)该反应的△H
(3)写出该反应的平衡常数表达式
(4)该反应的逆反应速率随时间变化的关系如图:
①从图中看到,反应在t2时达平衡,在t1时改变了某种条件,改变的条件可能是(填序号)
②如果在t3时从混合物中分离出部分CO,t4~t5时间段反应处于新平衡状态,请在图上画出t3~t5的V(逆)变化曲线.

考点:化学平衡的影响因素,化学平衡状态的判断
专题:化学平衡专题
分析:(1)可逆反应达到平衡状态时,正逆反应速率相等,反应体系中各物质物质的量不变、物质的量浓度不变以及又此引起的物理量不变,据此分析解答;
(2)升高温度,平衡向吸热反应方向移动,升高温度时平衡常数增大,说明平衡向正反应方向移动;
(3)该反应平衡常数表达式为
;根据方程式知,平衡时CO的浓度为1.0mol/L,则二氧化碳的浓度也是1.0mol/L,根据平衡常数K=
计算平衡常数;
(4)①从图中看到,反应在t2时达平衡,在t1时改变了某种条件,反应速率增大,且与原来没有接触点,且该反应是反应前后气体体积不变的可逆反应,所以改变的条件可能是温度;
②如果在t3时从混合物中分离出部分CO,物质的量浓度减小,反应速率减小,平衡向正反应方向移动,逆反应速率先减小有增大.
(2)升高温度,平衡向吸热反应方向移动,升高温度时平衡常数增大,说明平衡向正反应方向移动;
(3)该反应平衡常数表达式为
| c(CO) |
| c(CO2) |
| c(CO) |
| c(CO2) |
(4)①从图中看到,反应在t2时达平衡,在t1时改变了某种条件,反应速率增大,且与原来没有接触点,且该反应是反应前后气体体积不变的可逆反应,所以改变的条件可能是温度;
②如果在t3时从混合物中分离出部分CO,物质的量浓度减小,反应速率减小,平衡向正反应方向移动,逆反应速率先减小有增大.
解答:
解:(1)A.该反应的反应前后气体体积不变,所以容器内压强始终不变,所以不能据此判断平衡状态,故A错误;
B.c(CO)不变了,正逆反应速率相等,所以该反应达到平衡状态,则能据此判断平衡状态,故B正确;
C.v正(CO2)=v逆(CO)时,正逆反应速率相等,所以该反应达到平衡状态,则能据此判断平衡状态,故C正确;
D.c(CO2)=c(CO)时,该反应可能达到平衡状态也可能没有达到平衡状态,与反应初始浓度及转化率有关,所以不能据此判断平衡状态,故D错误;
故选BC;
(2)升高温度,平衡向吸热反应方向移动,升高温度时平衡常数增大,说明平衡向正反应方向移动,所以该反应的正反应是吸热反应,则△H>0,故答案为:>;
(3)该反应平衡常数表达式为
;根据方程式知,平衡时CO的浓度为1.0mol/L,则二氧化碳的浓度也是1.0mol/L,平衡常数K=
=
=1.0,
故答案为:K=
;1.0;
(4)①从图中看到,反应在t2时达平衡,在t1时改变了某种条件,反应速率增大,且与原来没有接触点,且该反应是反应前后气体体积不变的可逆反应,所以改变的条件可能是温度,故选A;
②如果在t3时从混合物中分离出部分CO,物质的量浓度减小,反应速率减小,平衡向正反应方向移动,逆反应速率先减小有增大,其图象为 ,
,
故答案为:A; .
.
B.c(CO)不变了,正逆反应速率相等,所以该反应达到平衡状态,则能据此判断平衡状态,故B正确;
C.v正(CO2)=v逆(CO)时,正逆反应速率相等,所以该反应达到平衡状态,则能据此判断平衡状态,故C正确;
D.c(CO2)=c(CO)时,该反应可能达到平衡状态也可能没有达到平衡状态,与反应初始浓度及转化率有关,所以不能据此判断平衡状态,故D错误;
故选BC;
(2)升高温度,平衡向吸热反应方向移动,升高温度时平衡常数增大,说明平衡向正反应方向移动,所以该反应的正反应是吸热反应,则△H>0,故答案为:>;
(3)该反应平衡常数表达式为
| c(CO) |
| c(CO2) |
| c(CO) |
| c(CO2) |
| 1.0 |
| 1.0 |
故答案为:K=
| c(CO) |
| c(CO2) |
(4)①从图中看到,反应在t2时达平衡,在t1时改变了某种条件,反应速率增大,且与原来没有接触点,且该反应是反应前后气体体积不变的可逆反应,所以改变的条件可能是温度,故选A;
②如果在t3时从混合物中分离出部分CO,物质的量浓度减小,反应速率减小,平衡向正反应方向移动,逆反应速率先减小有增大,其图象为
 ,
,故答案为:A;
 .
.
点评:本题考查化学平衡影响因素、平衡状态的判断等知识点,侧重考查学生基本理论、知识运用能力,知道只有反应前后改变的物理量才能作为平衡状态的判断依据,会根据反应方程式特点分析平衡影响因素,题目难度中等.

练习册系列答案
相关题目
由Fe2O3、Fe、CuO、C、Al中的几种物质组成的混合粉末,取样品进行下列实验(部分产物略去).关于混合粉末的组成判断正确的是( )


| A、一定含CuO和C |
| B、一定含Fe2O3、CuO和C |
| C、一定含CuO和C,一定不含Al |
| D、不管试剂a为H2O或饱和NaHCO3溶液,气体Z都为纯净物 |
为了除去粗盐固体中可能含有的少量Na2SO4和CaCl2杂质,须进行下列六项操作,正确的顺序是.( )
①加水溶解;
②加入过量BaCl2溶液;
③加热蒸发得到晶体;
④加入过量盐酸;
⑤加入过量Na2CO3;
⑥过滤.
①加水溶解;
②加入过量BaCl2溶液;
③加热蒸发得到晶体;
④加入过量盐酸;
⑤加入过量Na2CO3;
⑥过滤.
| A、①⑤②⑥④③ |
| B、①⑤②④⑥③ |
| C、①②④⑥⑤③ |
| D、①②⑤⑥④③ |
下列实验装置一般不用于分离物质的是( )
A、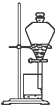 |
B、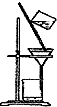 |
C、 |
D、 |
下列说法正确的是( )
| A、共价键都是极性的 |
| B、共价键的键能越大,共价键越牢固,含有该键的双原子分子越稳定 |
| C、CF4、CCl4、CBr4、CI4中C-X键的键长、键角均相等 |
| D、H2O分子中2个O-H键夹角为180° |