题目内容
6.设NA为阿伏伽德罗常数的值,下列说法正确的是( )| A. | 0.2mol丙烯酸中含有双键的数目为0.2NA | |
| B. | 丙烯和1-丁烯组成的21g混合气体中氢原子的个数为3NA | |
| C. | 标准状况下,11.2L苯中含有分子的数目为0.5NA | |
| D. | 1mol羟基与1mol氢氧根离子所含电子数均为9NA |
分析 A.1mol丙烯酸中含2mol双键;
B.乙烯和1-丁烯均由CH2构成;
C.标况下苯为液体;
D.羟基不带电荷;
解答 解:A.0.2mol丙烯酸中含有双键物质的量为0.4mol,数目为0.4NA,故A错误;
B.乙烯和1-丁烯均由CH2构成,故21g混合物中含有的CH2的物质的量1.5mol,故含有的氢原子为3mol即3NA个,故B正确;
C.标况下苯为液体,不能使用气体摩尔体积,故C错误;
D.羟基不带电荷,1mol-OH含9mol电子即9NA个,故D错误;
故选:B.
点评 本题考查阿伏加德罗常数的有关计算和判断,注意掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,明确标况下气体摩尔体积的使用条件,注意乙烷、丙烯酸的结构,题目难度不大.

练习册系列答案
 口算能手系列答案
口算能手系列答案
相关题目
16.饱和醇X的分子式为C5H12O,与足量乙酸反应生成酯Y,且X可由烯烃与水在一定条件下反应制得,Y的结构共有( )
| A. | 6种 | B. | 7种 | C. | 8种 | D. | 9种 |
14.化学深入我们的生活,下列相关说法不正确的是( )
| A. | 乙烯可作水果的催熟剂 | |
| B. | 开发利用各种新能源,减少对化石燃料的依赖,可以降低空气中PM2.5的含量 | |
| C. | 福尔马林可作食品的保鲜剂 | |
| D. | 生活中常用的淀粉、蔗糖、葡萄糖的组成元素相同 |
1.下列有关实验的说法正确的是( )
| A. | 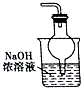 用如图装置除去乙酸乙酯中混有的少量乙酸 | |
| B. | 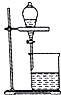 用如图装置可直接分离溴苯和溴 | |
| C. | 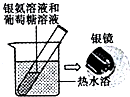 用如图装置验证葡萄糖分子有还原性 | |
| D. | 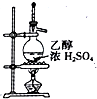 用如图装置制取乙烯 |
11.有碳原子数相同的烯烃、炔烃混合气xL,完全燃烧后生成yLCO2和zL水蒸气(温度、压强和原混合气相同),若x:y:z=3:6:4,则下列叙述正确的是( )
| A. | 原混合气为体积比为1:2的乙烯和乙炔 | |
| B. | 原混合气为体积比为1:1的丙烯和丙炔 | |
| C. | 原混合气为任意体积比的乙烯和乙炔 | |
| D. | 原混合气为体积比为1:2的乙烯和丙炔 |
18.下列各组离子,在指定的条件下一定能大量共存的是( )
| A. | NH4Fe(SO4)2的溶液中:H+、Mg2+、Br-、NO3- | |
| B. | 含有大量HCO3-的溶液:NH4+、Ca2+、AlO2-、I- | |
| C. | 浓度为3%的H2O2溶液:H+、Fe2+、C1-、SO42- | |
| D. | c(S2-)=0.1mo1.L-1的溶液中:Na+、NH4+、ClO-、SO42- |
15.中国将于2016年发射“天宫二号”空间实验室,“天宫二号”的供电系统中有再生氢氧燃料电池(RFC),RFC是一种将水电解技术与氢氧燃料电池技术相结合的可充电电池.如图为RFC工作原理示意图,有关说法正确的是( )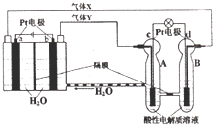

| A. | 有0.1mol电子转移时,a电极产生1.12LO2 | |
| B. | c极上发生还原反应,B中的H+可以通过隔膜进入A | |
| C. | b极上发生的电极反应是:4H2O+4e-=2H2↑+4OH- | |
| D. | d电极上发生的电极反应是:O2+4H++4e-=2H2O |

 .
.