题目内容
1.下列有关实验的说法正确的是( )| A. | 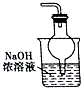 用如图装置除去乙酸乙酯中混有的少量乙酸 | |
| B. | 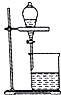 用如图装置可直接分离溴苯和溴 | |
| C. | 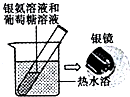 用如图装置验证葡萄糖分子有还原性 | |
| D. | 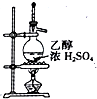 用如图装置制取乙烯 |
分析 A.乙酸乙酯在NaOH溶液中水解;
B.溴苯和溴互溶;
C.醛基能将银氨溶液还原为银单质;
D.温度计水银球与蒸馏烧瓶支管口处相平.
解答 解:A.乙酸乙酯在NaOH溶液中水解,应用饱和碳酸钠溶液分离,故A错误;
B.溴苯和溴互溶,不能用分液分离,故B错误;
C.醛基能将银氨溶液还原为银单质,可证明,故C正确;
D.温度计测量蒸气的温度,水银球与蒸馏烧瓶支管口处相平,故D错误.
故选C.
点评 本题考查较为综合,涉及基础实验操作,侧重于学生的分析能力和实验能力的考查,为高频考点,注意把握实验的方法、步骤和使用的仪器,注重相关基础知识的积累,难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
11.下表列出了①~⑩九种元素在周期表的位置:
(1)写出①③④⑨的元素符号Na、Mg、Al、S.
(2)写出⑦单质的化学式Cl2.灼烧②的化合物,透过蓝色钴玻璃可看见火焰呈紫色,
(3)写出①单质与水反应的化学方程式2Na+2H2O=2NaOH+H2↑.
(4)元素⑥的质子数为8,其原子核外有2个电子层.最外层电子数为6.
(5)元素④与⑥形成化合物的化学式为Al2O3,该化合物与盐酸反应的离子方程式为
Al2O3+6H+=2Al3++3H2O.
(6)单质⑦与石灰乳Ca(OH)2 反应可制得漂白粉,反应的化学方程式为2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O.漂白粉的有效成分为Ca(ClO)2.
(7)元素⑩的气态氢化物的化学式为NH3,其水溶液呈碱性,实验室制取该物质的化学方程式为2NH4Cl+Ca(OH)2=CaCl2+NH3↑+2H2O.
| 主族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
| 2 | ⑤ | ⑩ | ⑥ | |||||
| 3 | ① | ③ | ④ | ⑧ | ⑨ | ⑦ | ||
| 4 | ② |
(2)写出⑦单质的化学式Cl2.灼烧②的化合物,透过蓝色钴玻璃可看见火焰呈紫色,
(3)写出①单质与水反应的化学方程式2Na+2H2O=2NaOH+H2↑.
(4)元素⑥的质子数为8,其原子核外有2个电子层.最外层电子数为6.
(5)元素④与⑥形成化合物的化学式为Al2O3,该化合物与盐酸反应的离子方程式为
Al2O3+6H+=2Al3++3H2O.
(6)单质⑦与石灰乳Ca(OH)2 反应可制得漂白粉,反应的化学方程式为2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O.漂白粉的有效成分为Ca(ClO)2.
(7)元素⑩的气态氢化物的化学式为NH3,其水溶液呈碱性,实验室制取该物质的化学方程式为2NH4Cl+Ca(OH)2=CaCl2+NH3↑+2H2O.
12.下列对实验现象的解释与结论正确的是( )
| 实验现象 | 解释与结论 | |
| A | 向铜和稀硫酸的混合物中加入无色溶液,溶液逐渐变成蓝色,铜逐渐溶解 | 该无色溶液一定是硝酸 |
| B | 将某气体通入品红溶液中,品红溶液颜色 | 该气体一定是SO2 |
| C | SO2气体通过Ba(NO3)2溶液中,溶液出现浑浊现象 | 说明有BaSO3沉淀生成 |
| D | 向NaHCO3溶液中滴加酚酞试液,加热时溶液由淡红色变为红色,冷却后溶液由红色变为淡红色 | 说明HCO3在水溶液中存在水解平衡 |
| A. | A | B. | B | C. | C | D. | D |
16.下列有机化合物命名正确的是( )
| A. | 2-甲基-3-乙基-戊烷 | B. | 3、4-二甲基戊烷 | ||
| C. | 2-乙基丁烷 | D. | 1-甲基丙烷 |
6.设NA为阿伏伽德罗常数的值,下列说法正确的是( )
| A. | 0.2mol丙烯酸中含有双键的数目为0.2NA | |
| B. | 丙烯和1-丁烯组成的21g混合气体中氢原子的个数为3NA | |
| C. | 标准状况下,11.2L苯中含有分子的数目为0.5NA | |
| D. | 1mol羟基与1mol氢氧根离子所含电子数均为9NA |
11.卤族元素的单质和化合物很多,我们可以利用所学物质结构与性质的相关知识去认识和理解.
(1)卤族元素位于周期表的p区;溴的价电子排布式为4s24p5
(2)在不太稀的溶液中,氢氟酸是以二分子缔合(HF)2形式存在.使氢氟酸分子缔合的作用力是氢键
(3)请根据下表提供的第一电离能数据判断:最有可能生成较稳定的单核阳离子的卤素原子是碘
(4)已知高碘酸有两种形式,化学式分别为H5IO6(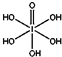 )和HIO4,前者为五元酸,后者为一元酸.请比较二者酸性强弱:H5IO6<HIO4(填“>”、“<”或“=”)
)和HIO4,前者为五元酸,后者为一元酸.请比较二者酸性强弱:H5IO6<HIO4(填“>”、“<”或“=”)
(5)已知ClO2-为角型,中心氯原子周围有四对价层电子.ClO2-中心氯原子的杂化轨道类型为sp3,写出CN-的等电子体的分子式N2或 CO(写出1个)
(6)如图1为碘晶体晶胞结构.有关说法中正确的是AD
A.碘分子的排列有2种不同的取向,2种取向不同的碘分子以4配位数交替配位形成层结构
B.用均摊法可知平均每个晶胞中有4个碘原子
C.碘晶体为无限延伸的空间结构,是原子晶体
D.碘晶体中的碘原子间存在非极性键和范德华力
(7)已知CaF2晶体(见图2)的密度为ρg/cm3,NA为阿伏加德罗常数,相邻的两个Ca2+的核间距为a cm,则CaF2的相对分子质量可以表示为$\frac{\sqrt{2}}{2}$ρNAa3

(1)卤族元素位于周期表的p区;溴的价电子排布式为4s24p5
(2)在不太稀的溶液中,氢氟酸是以二分子缔合(HF)2形式存在.使氢氟酸分子缔合的作用力是氢键
(3)请根据下表提供的第一电离能数据判断:最有可能生成较稳定的单核阳离子的卤素原子是碘
| 氟 | 氯 | 溴 | 碘 | 铍 | |
| 第一电离能 (kJ/mol) | 1681 | 1251 | 1140 | 1008 | 900 |
 )和HIO4,前者为五元酸,后者为一元酸.请比较二者酸性强弱:H5IO6<HIO4(填“>”、“<”或“=”)
)和HIO4,前者为五元酸,后者为一元酸.请比较二者酸性强弱:H5IO6<HIO4(填“>”、“<”或“=”)(5)已知ClO2-为角型,中心氯原子周围有四对价层电子.ClO2-中心氯原子的杂化轨道类型为sp3,写出CN-的等电子体的分子式N2或 CO(写出1个)
(6)如图1为碘晶体晶胞结构.有关说法中正确的是AD
A.碘分子的排列有2种不同的取向,2种取向不同的碘分子以4配位数交替配位形成层结构
B.用均摊法可知平均每个晶胞中有4个碘原子
C.碘晶体为无限延伸的空间结构,是原子晶体
D.碘晶体中的碘原子间存在非极性键和范德华力
(7)已知CaF2晶体(见图2)的密度为ρg/cm3,NA为阿伏加德罗常数,相邻的两个Ca2+的核间距为a cm,则CaF2的相对分子质量可以表示为$\frac{\sqrt{2}}{2}$ρNAa3

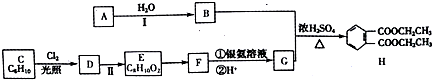
 等.
等.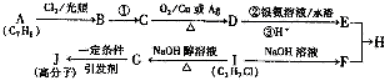
 ,发生反应①的条件是氢氧化钠水溶液、加热.
,发生反应①的条件是氢氧化钠水溶液、加热. .
.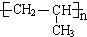 .
. .
. .
.