题目内容
下列判断正确的是( )
| A、对某溶液进行焰色反应时火焰颜色为黄色,则该溶液中一定有Na+,可能有K+ |
| B、向某溶液中加入AgNO3溶液产生白色沉淀,加入洗盐酸时沉淀不溶解,可确定有Cl-存在 |
| C、加入盐酸时有能使澄清石灰水变浑浊的气体生成,则原溶液中一定有CO32-存在 |
| D、分别含有Mg2+、Cu2+、Fe2+和Na+四种离子的溶液,只用NaOH溶液不可能鉴别成功 |
考点:常见阳离子的检验,常见阴离子的检验
专题:物质检验鉴别题
分析:A.检验K+需要透过蓝色钴玻璃;
B.氯离子、硫酸根均能与银离子反应生成不溶于稀盐酸的白色沉淀;
C.碳酸氢根与盐酸反应也生成二氧化碳,并且二氧化硫与澄清石灰水反应也生成沉淀;
D.氢氧根与钠离子不反应,氢氧根与Mg2+、Cu2+、Fe2+反应现象分别为白色沉淀、蓝色沉淀、白色沉淀迅速变为灰绿色最后变为红褐色.
B.氯离子、硫酸根均能与银离子反应生成不溶于稀盐酸的白色沉淀;
C.碳酸氢根与盐酸反应也生成二氧化碳,并且二氧化硫与澄清石灰水反应也生成沉淀;
D.氢氧根与钠离子不反应,氢氧根与Mg2+、Cu2+、Fe2+反应现象分别为白色沉淀、蓝色沉淀、白色沉淀迅速变为灰绿色最后变为红褐色.
解答:
解:A.焰色反应焰颜色为黄色,则该溶液中一定有Na+,黄色火焰可以覆盖K+的浅紫色火焰,故检验K+需通过蓝色钴玻璃观察火焰,不能确定是否含有K+,故A正确;
B.氯离子、硫酸根均能与银离子反应生成不溶于稀盐酸的白色沉淀,不能确定溶液中有Cl-存在,故B错误;
C.碳酸氢根与盐酸反应也生成二氧化碳,亚硫酸根、亚硫酸氢根与盐酸反应生成二氧化硫也能使澄清石灰水变浑浊,故C错误;
D.氢氧根与Mg2+、Cu2+反应分别产生白色沉淀、蓝色沉淀,与Fe2+反应生成的白色沉淀迅速变为灰绿色最后变为红褐色,氢氧根与钠离子不反应,可以一次性鉴别出来,故D错误;
故选A.
B.氯离子、硫酸根均能与银离子反应生成不溶于稀盐酸的白色沉淀,不能确定溶液中有Cl-存在,故B错误;
C.碳酸氢根与盐酸反应也生成二氧化碳,亚硫酸根、亚硫酸氢根与盐酸反应生成二氧化硫也能使澄清石灰水变浑浊,故C错误;
D.氢氧根与Mg2+、Cu2+反应分别产生白色沉淀、蓝色沉淀,与Fe2+反应生成的白色沉淀迅速变为灰绿色最后变为红褐色,氢氧根与钠离子不反应,可以一次性鉴别出来,故D错误;
故选A.
点评:本题考查离子检验、对实验方案的评价,关键掌握常见离子的检验方法,注意排除其它离子的干扰.

练习册系列答案
 黄冈小状元解决问题天天练系列答案
黄冈小状元解决问题天天练系列答案 三点一测快乐周计划系列答案
三点一测快乐周计划系列答案
相关题目
某溶液中可能含有Cl-、SO42-、CO32-、NH4+、Fe3+、Al3+和K+,进行如下实验:
(1)取该溶液100mL,加入过量NaOH溶液,加热,得到0.01 mol 气体,同时产生红褐色沉淀;过滤,将沉淀洗涤,灼烧,得到0.8 g固体;
(2)向(1)的滤液中通入足量CO2,过滤,得到0.01 mol沉淀;
(3)向(2)的滤液中加入足量用盐酸酸化的BaCl2溶液,得到2.33g沉淀,
由此可知原溶液中( )
(1)取该溶液100mL,加入过量NaOH溶液,加热,得到0.01 mol 气体,同时产生红褐色沉淀;过滤,将沉淀洗涤,灼烧,得到0.8 g固体;
(2)向(1)的滤液中通入足量CO2,过滤,得到0.01 mol沉淀;
(3)向(2)的滤液中加入足量用盐酸酸化的BaCl2溶液,得到2.33g沉淀,
由此可知原溶液中( )
| A、至少存在CO32-、Cl-中的一种 |
| B、Cl-一定存在,K+可能存在 |
| C、Cl-一定存在,且c(Cl-)≥0.6mol?L-1 |
| D、溶液中至少存在4种离子 |
 金属钠和过氧化钠分别与水反应有很多值得探究的问题.
金属钠和过氧化钠分别与水反应有很多值得探究的问题.




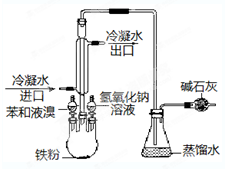 如图是实验室制取溴苯的装置图:
如图是实验室制取溴苯的装置图: