题目内容
下列有关物质的性质的叙述中正确的是( )
| A、向CuS04溶液中加入铁时会置换出铜,可推向CuS04溶液中加入钠时也会置换出铜 |
| B、氢氟酸的酸性比盐酸弱,故非金属性是F>Cl |
| C、丁达尔效应是胶体的本质特征 |
| D、MgO可以除去MgCl2溶液中含有的FeCl3 |
考点:钠的化学性质,胶体的重要性质,同一周期内元素性质的递变规律与原子结构的关系,物质的分离、提纯和除杂
专题:
分析:A.向CuS04溶液中加入钠时,钠先与水反应生成氢氧化钠和氢气,氢氧化钠再与硫酸铜反应生成氢氧化铜的沉淀;
B.同主族元素的原子,从上到下,得电子能力减弱,氧化性减弱,它们的最高价氧化物的水化物酸性逐渐减弱;
C.胶体的本质特征是胶体粒子的大小在1~100nm;
D.根据FeCl3易水解生成氢氧化铁.
B.同主族元素的原子,从上到下,得电子能力减弱,氧化性减弱,它们的最高价氧化物的水化物酸性逐渐减弱;
C.胶体的本质特征是胶体粒子的大小在1~100nm;
D.根据FeCl3易水解生成氢氧化铁.
解答:
解:A.向CuS04溶液中加入钠时,钠先与水反应生成氢氧化钠和氢气,氢氧化钠再与硫酸铜反应生成氢氧化铜的沉淀,所以不会置换出铜,故A错误;
B.HF、HCl都不是最高价氧化物的水化物,无法利用HF、HCl的酸性来比较F、Cl非金属性弱即氧化性强弱,故B错误;
C.胶体的本质特征是胶体粒子的大小在1~100nm,丁达尔效应是胶体特有的性质,故C错误;
D.FeCl3易水解生成氢氧化铁,加入MgO,调节溶液的pH,促进铁离子的水解,且不引入新的杂质,故D正确;
故选D.
B.HF、HCl都不是最高价氧化物的水化物,无法利用HF、HCl的酸性来比较F、Cl非金属性弱即氧化性强弱,故B错误;
C.胶体的本质特征是胶体粒子的大小在1~100nm,丁达尔效应是胶体特有的性质,故C错误;
D.FeCl3易水解生成氢氧化铁,加入MgO,调节溶液的pH,促进铁离子的水解,且不引入新的杂质,故D正确;
故选D.
点评:本题考查了钠的性质、盐的水解、胶体的性质、非金属性的比较方法,考查的知识点较多,属于基础知识的考查,题目难度不大.

练习册系列答案
相关题目
某无色溶液中由水电离产生的c(H+)和c(OH-)的乘积为1×10-22( 25℃),下列离子组在此溶液中能大量共存的是( )
| A、MnO4- Cl- NH4+ Na+ |
| B、CO32- NO3- Ca2+Na+ |
| C、SO42- HCO3- K+ Na+ |
| D、SO42-NO3-K+ Na+ |
下列说法中,正确的是( )
| A、强电解质溶液一定比弱电解质溶液导电能力强 |
| B、不溶性盐是弱电解质 |
| C、强电解质的水溶液中不存在溶质分子 |
| D、因为醋酸是弱电解质,盐酸是强电解质,因此中和等体积等物质的量浓度的醋酸和盐酸时,中和盐酸消耗的氢氧化钠比中和醋酸多 |
(NH4)2PtCl6 晶体受热分解生成氮气、氯化氢、氯化铵和金属铂.在此分解反应中,氧化产物与还原产物的物质的量之比是( )
| A、1:3 | B、1:2 |
| C、3:2 | D、2:3 |
如图所示铜锌电池,下列叙述错误的是( )
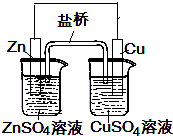

| A、锌是负极,发生氧化反应 |
| B、铜是正极,发生还原反应 |
| C、电流是从Zn流出经导线流入铜电极 |
| D、锌电极质量减少,铜电极质量增加 |
