题目内容
对于ⅣA族元素,下列叙述中正确的是( )
| A、硅酸钠属于盐,不属于碱,所以硅酸钠可以保存在磨口玻璃塞试剂瓶中 |
| B、Si和Ge的最外层电子数都是4,次外层电子数都是8 |
| C、用SiO2制取硅酸,应先使二氧化硅与氢氧化钠溶液反应,然后再通入CO2 |
| D、石英砂与烧碱溶液反应制水玻璃的离子方程式:2Na++SiO2+2OH-═Na2SiO3+H2O |
考点:硅和二氧化硅,含硅矿物及材料的应用
专题:碳族元素
分析:A.硅酸钠不能保存在磨口玻璃塞试剂瓶中;
B.Ge原子的次外层电子数是18;
C.二氧化硅和水不反应,但能溶于强碱,碳酸的酸性大于硅酸,根据强酸制取弱酸分析;
D.石英砂的主要成分是二氧化硅,二氧化硅能和氢氧化钠溶液反应生成强电解质硅酸钠.
B.Ge原子的次外层电子数是18;
C.二氧化硅和水不反应,但能溶于强碱,碳酸的酸性大于硅酸,根据强酸制取弱酸分析;
D.石英砂的主要成分是二氧化硅,二氧化硅能和氢氧化钠溶液反应生成强电解质硅酸钠.
解答:
解:A.硅酸钠属于粘性的物质,能将玻璃塞和试剂瓶粘结在一起而打不开,故A错误;
B.Ge原子的次外层电子数是18,Si原子的次外层电子数是8,故B错误;
C.二氧化硅和水不反应,但能溶于强碱,碳酸的酸性大于硅酸,所以制取硅酸的方法为用SiO2制取硅酸,应先使二氧化硅与氢氧化钠溶液反应,然后再通入CO2,从而得到硅酸,故C正确;
D.石英砂的主要成分是二氧化硅,二氧化硅能和氢氧化钠溶液反应生成强电解质硅酸钠,离子方程式为SiO2+2OH-═SiO32-+H2O,故D错误;
故选C.
B.Ge原子的次外层电子数是18,Si原子的次外层电子数是8,故B错误;
C.二氧化硅和水不反应,但能溶于强碱,碳酸的酸性大于硅酸,所以制取硅酸的方法为用SiO2制取硅酸,应先使二氧化硅与氢氧化钠溶液反应,然后再通入CO2,从而得到硅酸,故C正确;
D.石英砂的主要成分是二氧化硅,二氧化硅能和氢氧化钠溶液反应生成强电解质硅酸钠,离子方程式为SiO2+2OH-═SiO32-+H2O,故D错误;
故选C.
点评:本题考查了硅及其化合物、原子结构等知识点,根据硅酸钠、二氧化硅等物质的性质来分析解答,会运用化学语言解释盛放强碱的试剂瓶不能用玻璃塞子的原因,知道硅酸的制取方法,题目难度不大.

练习册系列答案
相关题目
甲烷是重要的生活和工业原料,下列有关甲烷叙述不正确的是( )
| A、常温常压下是气体 |
| B、常温常压下性质很稳定 |
| C、不能使酸性高锰酸钾溶液褪色 |
| D、可以使溴水褪色 |
下列反应类型的判断,不正确的是( )
| A、CO2+H2O?H2CO3 化合反应 | ||||
B、Cu(OH)2
| ||||
C、MnO2+2CO
| ||||
| D、NaCl+AgNO3═AgCl↓+NaNO3 复分解反应 |
化学无处不在,下列与化学有关的说法不正确的是( )
| A、新鲜蔬菜做熟后,所含维生素C会有损失 |
| B、糖类、油脂和蛋白质在人体内均可水解为葡萄糖,故可作人类的营养物质 |
| C、次氯酸钠溶液可用于环境的消毒杀菌 |
D、 和CO2反应生成可降解聚合物 和CO2反应生成可降解聚合物 ,该反应符合绿色化学的原则. ,该反应符合绿色化学的原则. |
M2O3中M元素的化合价为( )
| A、+3 | B、+5 | C、+4 | D、+6 |
油脂能增加食物的滋味,增进食欲,保证机体的正常生理功能.但摄入过量脂肪,可能引起肥胖、高血脂、高血压等.下列食品中富含油脂的是( )
| A、苹果 | B、大米 | C、白菜 | D、花生 |
工业上用某种氧化铝矿石(含Fe2O3杂质)为原料冶炼铝的工艺流程如下:
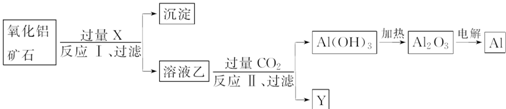
下列说法正确的是( )

下列说法正确的是( )
A、反应Ⅱ为CO2+2AlO
| ||
| B、CO2可以用H2SO4溶液或稀盐酸代替 | ||
| C、制取的铝单质与少量NaOH溶液反应的离子方程式为:Al+3OH-=Al(OH)3↓ | ||
| D、试剂X可以为NaOH溶液,沉淀中含有铁的化合物 |
一定条件下,将5molH2和1molN2充入一密闭容器中,发生反应:N2+3H2?2NH3(各物质均为气态),达到平衡时,H2的转化率不可能是( )
| A、20% | B、35% |
| C、50% | D、65% |
下列说法正确的是( )
| A、由极性键构成的分子都是极性分子 |
| B、含非极性键的分子一定是非极性分子 |
| C、极性分子一定含有极性键,非极性分子一定含有非极性键 |
| D、以极性键结合的双原子分子,一定是极性分子 |