题目内容
3.无水AlCl3可用作有机合成的催化剂、食品膨松剂等.工业上可由铝土矿(主要成分是Al2O3和Fe2O3)和焦炭制备,流程如下: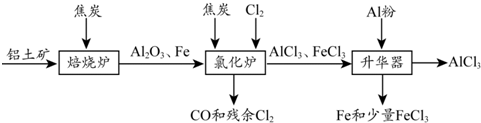
已知:AlCl3、FeCl3分别在183℃、315℃时升华
(1)Cl2的电子式
 .
.(2)氯化炉中Al2O3、Cl2和焦炭在高温下发生反应的化学方程式为Al2O3+3Cl2+3C$\frac{\underline{\;高温\;}}{\;}$2AlCl3+3CO;炉气中残余
的少量Cl2,可用NaOH溶液吸收,其离子方程式为Cl2+2OH-=Cl-+ClO-+H2O.
(3)700℃时,升华器中物质经充分反应后需降温实现FeCl3和AlCl3的分离.请选择合适的温度范围b.
a.低于183℃b.介于183℃和315℃之间 c.高于315℃
(4)样品(含少量FeCl3)中AlCl3含量可通过下列操作测得(部分物质略去).

计算该样品中AlCl3的质量分数$\frac{267n}{102m}×$100%(结果用m、n表示,不必化简).
分析 铝土和焦炭矿焙烧炉中加热,Fe2O3被还原得到Fe,所以反应后得到Al2O3和Fe,加入Cl2、焦炭在氯化炉中反应,Fe、Al2O3、C12和C反应会生成A1C13、FeC13、CO,排出废气CO和Cl2,加入Al粉除去FeC13、Fe,最后得到A1C13,冷凝得到A1C13固体,
(1)Cl2分子中两个Cl原子之间共用一对电子;
(2)氯化炉中Al2O3、Cl2和焦炭在高温下发生反应生成氯化铝和CO;炉气中残余
的少量Cl2,可用NaOH溶液吸收,氯气和NaOH反应生成NaCl、NaClO和水;
(3)700℃时,升华器中物质经充分反应后需降温实现FeCl3和AlCl3的分离,温度范围应该介于183℃和315℃之间;
(4)根据Al原子守恒得关系式AlCl3~NaAlO2~Al(OH)3~$\frac{1}{2}$Al2O3,根据氯化铝和氧化铝之间的关系式计算氯化铝质量,从而计算氯化铝在样品中的质量分数.
解答 解:铝土和焦炭矿焙烧炉中加热,Fe2O3被还原得到Fe,所以反应后得到Al2O3和Fe,加入Cl2、焦炭在氯化炉中反应,Fe、Al2O3、C12和C反应会生成A1C13、FeC13、CO,排出废气CO和Cl2,加入Al粉除去FeC13、Fe,最后得到A1C13,冷凝得到A1C13固体,
(1)Cl2分子中两个Cl原子之间共用一对电子,氯气分子电子式为 ,故答案为:
,故答案为: ;
;
(2)氯化炉中Al2O3、Cl2和焦炭在高温下发生反应生成氯化铝和CO,反应方程式为Al2O3+3Cl2+3C$\frac{\underline{\;高温\;}}{\;}$2AlCl3+3CO;炉气中残余的少量Cl2,可用NaOH溶液吸收,氯气和NaOH反应生成NaCl、NaClO和水,离子方程式为Cl2+2OH-=Cl-+ClO-+H2O,故答案为:Al2O3+3Cl2+3C$\frac{\underline{\;高温\;}}{\;}$2AlCl3+3CO;Cl2+2OH-=Cl-+ClO-+H2O;
(3)700℃时,升华器中物质经充分反应后需降温实现FeCl3和AlCl3的分离,温度范围应该介于183℃和315℃之间,故选b;
(4)根据Al原子守恒得关系式AlCl3~NaAlO2~Al(OH)3~$\frac{1}{2}$Al2O3,根据氯化铝和氧化铝之间的关系式得m(AlCl3)=$\frac{\frac{ng}{102g/mol}}{\frac{1}{2}}×1×133.5g/mol$=$\frac{267n}{102}$g,氯化铝的质量分数=$\frac{\frac{267n}{102}g}{m}×100%$=$\frac{267n}{102m}×$100%,
故答案为:$\frac{267n}{102m}×$100%.
点评 本题考查物质制备,为高频考点,涉及物质的量计算、基本操作、氧化还原反应、物质分离和提纯等知识点,明确实验原理、基本计算、物质分离和提纯等知识点即可解答,难点是(4)题计算,要明确物质之间关系,题目难度不大.

| A. | 澄清的石灰水与盐酸的反应:OH-+H+═H2O | |
| B. | 氧化镁与稀硝酸反应:O2-+2H+═H2O | |
| C. | 硫酸镁溶液与氢氧化钡溶液与混合:Ba2++SO42-═BaSO4↓ | |
| D. | 碳酸钙溶于稀盐酸中:CO32-+2H+═H2O+CO2↑ |
| A. | 第3周期非金属元素含氧酸的酸性从左到右依次增强 | |
| B. | HCl、H2S、PH3的稳定性逐渐减弱 | |
| C. | 第3周期自左往右原子和离子半径均依次减小 | |
| D. | 向MgCl2溶液中加入金属钠发生2Na+MgC12═2NaC1+Mg,所以金属性Na>Mg |
| B | C |
| D |
| A. | 简单离子的半径大小关系:C>E | |
| B. | 因C元素气态氢化物的沸点比D元素气态氢化物高,所以C原子得电子能力大于D原子 | |
| C. | 由A、B、C三种元素组成的离子化合物中,阴、阳离子个数比为1:1 | |
| D. | 由C、D、E三种元素组成的化合物,溶液显中性或碱性 |
| A. | 向氯水中滴加NaHCO3,有气泡产生,说明氯水中含有HCl和HClO | |
| B. | 向FeCl2溶液中滴加氯水,溶液变成棕黄色,说明氯水中含有HClO | |
| C. | 氯水呈浅黄绿色,说明氯水中含有Cl2 | |
| D. | 向氯水中滴加硝酸酸化的AgNO3溶液,产生白色沉淀,说明氯水中含Cl- |
| A. | 氢氧燃电池在碱性介质中负极的反应式是:O2+2H2O+4e-=4OH- | |
| B. | NaHCO3在水溶液中的水解离子方程式:HCO3-+H2O?CO2↑+OH- | |
| C. | 用FeS为沉淀剂除去废水中的Hg2+:FeS(s)+Hg2+(aq)=HgS(s)+Fe2+ (aq) | |
| D. | 钢铁发生电化学腐蚀的正极反应式:Fe-2e-=Fe2+ |
| A. | 常温常压下,11.2L甲烷中含有的氢原子数为2NA | |
| B. | 分子数为NA的CO、C2H4混合气体体积约为22.4L,质量为28g | |
| C. | 高温下,16.8g铁与足量的水蒸气充分反应,失去的电子数为0.8NA | |
| D. | 标准状况下,2.24L戊烷所含分子数为0.1NA |