题目内容
 化学反应速率与生产、生活密切相关.
化学反应速率与生产、生活密切相关.(1)某学生为了探究锌与盐酸反应过程中的速率变化,他在200mL稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气,实验记录如下(累计值):
| 时间(min) | 1 | 2 | 3 | 4 | 5 |
| 氢气体积(mL)(标准状况) | 50 | 120 | 232 | 288 | 310 |
②求3~4分钟时间段以盐酸的浓度变化来表示的该反应速率
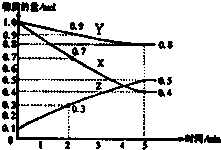
(2)已知某温度时,在2L容器中X、Y、Z三种物质随时间的变化关系曲线如图所示.该反应的化学方程式为:
考点:物质的量或浓度随时间的变化曲线
专题:化学平衡专题
分析:(1)①在0~1、1~2、2~3、3~4、4~5min时间段中,产生气体的体积分别为50mL、70mL、112mL、68mL、20mL,生成气体体积越大的时间段,反应速率越大,结合温度、浓度对反应速率的影响分析;
②计算出氢气的体积,根据2HCl~H2,计算消耗盐酸的物质的量,计算浓度的变化,根据v=
计算反应速率;
(2)根据反应中各物质的物质的量的变化量之比等于化学计量数之比,可写出化学方程式;
②计算出氢气的体积,根据2HCl~H2,计算消耗盐酸的物质的量,计算浓度的变化,根据v=
| △c |
| △t |
(2)根据反应中各物质的物质的量的变化量之比等于化学计量数之比,可写出化学方程式;
解答:
解:(1)在0~1、1~2、2~3、3~4、4~5min时间段中,产生气体的体积分别为50mL、70mL、112mL、56mL、22mL,由此可知反应速率最大的时间段为2~3 min;
故答案为:2~3 min;因反应为放热反应,温度升高,反应速率增大;
(3)在3~4min时间段内,n(H2)=
=0.0025mol,根据2HCl~H2,计算消耗盐酸的物质的量为0.005mol,则υ(HCl)=
=0.025 mol/(L?min);
(2)根据图象可知,在反应过程中X、Y的物质的量减小,为反应物,Z的物质的量增加,为生成物,化学反应中各物质的物质的量变化量之比等于化学计量数之比,则有△n(X):△n(Y):△n(Z)=(1.0mol-0.4mol):(1.0mol-0.8mol):(0.5mol-0.1mol=3:1:2,则反应的化学方程式为3X+Y 2Z,故答案为:3X+Y
2Z,故答案为:3X+Y 2Z.
2Z.
故答案为:2~3 min;因反应为放热反应,温度升高,反应速率增大;
(3)在3~4min时间段内,n(H2)=
| 0.056L |
| 22.4L/mol |
| ||
| 1min |
(2)根据图象可知,在反应过程中X、Y的物质的量减小,为反应物,Z的物质的量增加,为生成物,化学反应中各物质的物质的量变化量之比等于化学计量数之比,则有△n(X):△n(Y):△n(Z)=(1.0mol-0.4mol):(1.0mol-0.8mol):(0.5mol-0.1mol=3:1:2,则反应的化学方程式为3X+Y
 2Z,故答案为:3X+Y
2Z,故答案为:3X+Y 2Z.
2Z.
点评:本题考查反应速率的探究,难度中等.要注意根据把握影响反应速率的因素及根据有关数据写化学方程式,掌握基础是关键.

练习册系列答案
 浙大优学小学年级衔接导与练浙江大学出版社系列答案
浙大优学小学年级衔接导与练浙江大学出版社系列答案 小学暑假作业东南大学出版社系列答案
小学暑假作业东南大学出版社系列答案 津桥教育暑假拔高衔接广东人民出版社系列答案
津桥教育暑假拔高衔接广东人民出版社系列答案 波波熊暑假作业江西人民出版社系列答案
波波熊暑假作业江西人民出版社系列答案
相关题目
下列曲线表示卤素元素某种性质随核电荷数的变化趋势,正确的是( )
A、 |
B、 |
C、 |
D、 |
下列说法不正确的是( )
| A、化学合成和分离技术是人类生存所必须的,是其他各项技术的基础 |
| B、氨基酸是指分子中含有-COOH和-NH2,且连在同一个碳原子上 |
| C、根据纤维在火焰上燃烧产生的气味,确定该纤维是否为蛋白质纤维 |
| D、Na2SiO3的水溶液俗称水玻璃,用水玻璃浸泡的木材、纺织品耐火耐腐蚀 |
 (1)氢能是高效、清洁能源,制氢技术的研究开发是氢能利用的必由之路.燃料水蒸气重整法是一种有效、经济、广泛采用的制氢方法,它是通过水蒸气与燃料间的反应来制取氢气的.①在催化剂作用下,天然气和水蒸气反应可制得一氧化碳和氢气,已知该反应每制得1kg氢气需要吸收3.44×104 kJ热量,请写出该反应的热化学式:
(1)氢能是高效、清洁能源,制氢技术的研究开发是氢能利用的必由之路.燃料水蒸气重整法是一种有效、经济、广泛采用的制氢方法,它是通过水蒸气与燃料间的反应来制取氢气的.①在催化剂作用下,天然气和水蒸气反应可制得一氧化碳和氢气,已知该反应每制得1kg氢气需要吸收3.44×104 kJ热量,请写出该反应的热化学式: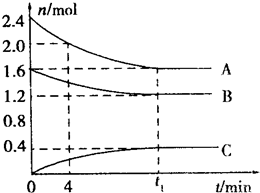 T℃时,在一容积为2L的容器中,A气体和B气体反应生成C气体,反应过程中A、B、C浓度变化如图所示:
T℃时,在一容积为2L的容器中,A气体和B气体反应生成C气体,反应过程中A、B、C浓度变化如图所示: 该蓄电池结构和反应原理如图,其中放电时是一个
该蓄电池结构和反应原理如图,其中放电时是一个