题目内容
下列曲线表示卤素元素某种性质随核电荷数的变化趋势,正确的是( )
A、 |
B、 |
C、 |
D、 |
考点:卤素原子结构及其性质的比较
专题:元素周期律与元素周期表专题,卤族元素
分析:A.同主族元素从上到下元素的电负性依次递减;
B.F没有正价;
C.同主族元素从上到下非金属性依次减弱,气态氢化物的稳定性依次减弱;
D.分子晶体,相对分子质量越大,分子间作用力越强,沸点越高.
B.F没有正价;
C.同主族元素从上到下非金属性依次减弱,气态氢化物的稳定性依次减弱;
D.分子晶体,相对分子质量越大,分子间作用力越强,沸点越高.
解答:
解:A.同主族元素从上到下元素的电负性依次递减,故A正确;
B.F没有正价,故B错误;
C.同主族元素从上到下非金属性依次减弱,气态氢化物的稳定性依次减弱,故C错误;
D.F2、Cl2、Br2,都属于分子晶体,相对分子质量依次增大,分子间作用力依次增强,所以沸点依次升高,故D错误;
故选:A.
B.F没有正价,故B错误;
C.同主族元素从上到下非金属性依次减弱,气态氢化物的稳定性依次减弱,故C错误;
D.F2、Cl2、Br2,都属于分子晶体,相对分子质量依次增大,分子间作用力依次增强,所以沸点依次升高,故D错误;
故选:A.
点评:本题考查了卤素元素性质的递变规律,题目难度不大,依据周期表中同主族元素性质的递变规律不难解答,易错选项为D,注意晶体沸点高低的规律.

练习册系列答案
相关题目
下列仪器中可直接加热的是( )
| A、圆底烧瓶 | B、坩埚 |
| C、量筒 | D、烧杯 |
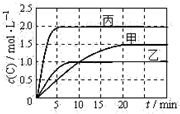 向甲、乙、丙三个密闭容器中充入一定量的A和B,发生反应:A(g)+xB(g)?2C(g).各容器的反应温度、反应物起始量,反应过程中C的浓度随时间变化关系分别以
向甲、乙、丙三个密闭容器中充入一定量的A和B,发生反应:A(g)+xB(g)?2C(g).各容器的反应温度、反应物起始量,反应过程中C的浓度随时间变化关系分别以 | 容器 | 甲 | 乙 | 丙 |
| 容积 | 0.5L | 0.5L | 1.0L |
| 温度/℃ | T1 | T2 | T2 |
| 反应物 起始量 | 1.5mol A 0.5mol B | 1.5mol A 0.5mol B | 6.0mol A 2.0mol B |
| A、10min内甲容器中反应的平均速率:v(A)=0.05mol?(L?min)-1 |
| B、由图可知T1>T2,且该反应为吸热反应 |
| C、x=1,若平衡时保持温度不变,改变容器体积平衡不移动 |
| D、T2℃,丙容器比乙容器反应快的原因可能是使用了催化剂 |
 由E(金属铁)制备的E(C5H5)2的结构如图甲所示,其中氢原子的化学环境完全相同.但早期人们却错误地认为它的结构如图乙所示.核磁共振法能区分这两种结构.图甲和图乙的核磁共振氢谱中含有的吸收峰分别为( )
由E(金属铁)制备的E(C5H5)2的结构如图甲所示,其中氢原子的化学环境完全相同.但早期人们却错误地认为它的结构如图乙所示.核磁共振法能区分这两种结构.图甲和图乙的核磁共振氢谱中含有的吸收峰分别为( )| A、1种 1种 |
| B、1种 2种 |
| C、1种 3种 |
| D、2种 3种 |
下列说法中正确的是( )
| A、原子及其离子的核外电子层数等于该元素所在的周期数 |
| B、元素周期表中从ⅢB族到ⅡB族 10个纵行的元素都是金属元素 |
| C、第ⅠA族元素的金属性比第ⅡA族元素的金属性强 |
| D、在周期表里,主族元素所在的族序数等于原子核外电子数 |
 化学反应速率与生产、生活密切相关.
化学反应速率与生产、生活密切相关. 则乙醇发生酯化反应时,断裂的键是
则乙醇发生酯化反应时,断裂的键是 ②CH2=CH2③CH≡CH ④
②CH2=CH2③CH≡CH ④ -CH2OH⑤
-CH2OH⑤ -CH3⑥CH3COO-
-CH3⑥CH3COO- ⑦CH3CH2CH2CH2Br中属于芳香烃的是
⑦CH3CH2CH2CH2Br中属于芳香烃的是