题目内容
 (1)氢能是高效、清洁能源,制氢技术的研究开发是氢能利用的必由之路.燃料水蒸气重整法是一种有效、经济、广泛采用的制氢方法,它是通过水蒸气与燃料间的反应来制取氢气的.①在催化剂作用下,天然气和水蒸气反应可制得一氧化碳和氢气,已知该反应每制得1kg氢气需要吸收3.44×104 kJ热量,请写出该反应的热化学式:
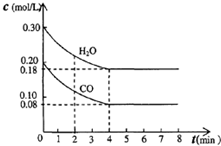
(1)氢能是高效、清洁能源,制氢技术的研究开发是氢能利用的必由之路.燃料水蒸气重整法是一种有效、经济、广泛采用的制氢方法,它是通过水蒸气与燃料间的反应来制取氢气的.①在催化剂作用下,天然气和水蒸气反应可制得一氧化碳和氢气,已知该反应每制得1kg氢气需要吸收3.44×104 kJ热量,请写出该反应的热化学式:(2)某温度时,在一体积为10L的容器中,通入2mol CO(g)和3mol H2O(g)发生如下反应:CO(g)十H2O(g)?CO2(g)十H2 (g);△H<0 各物质浓度变化如图所示:
①0-4min的平均反应速率v(H2O)=
②该温度下,此反应的平衡常数K=
③该反应达到平衡时CO的转化率为
④能判断该反应达到化学平衡状态的依据是
A、容器中压强不变
B、混合气体中c(CO)不变
C、V(H2)正=V(H2O)逆
D、c(CO2)=c(CO)
⑤若保持其他条件不变,向原平衡体系中再充入3molCO,则化学平衡向
考点:物质的量或浓度随时间的变化曲线,反应热和焓变,化学平衡的影响因素
专题:化学反应中的能量变化,化学平衡专题
分析:(1)①写出化学方程式,并计算出生成一定量氢气的热效应,得到热化学方程式;
②根据盖斯定律计算得到答案;
(2)①利用0-4min内H2O的浓度变化,计算化学反应速率;
②利用平衡时各物质浓度计算化学平衡常数;
③转化的CO的浓度与起始浓度的比值获得CO的转化率;
④利用化学平衡状态特征判断;
⑤若保持其他条件不变,向原平衡体系中再充入3molCO,增大反应物浓度,化学平衡向正反应方向移动;化学平衡常数只与温度有关.
②根据盖斯定律计算得到答案;
(2)①利用0-4min内H2O的浓度变化,计算化学反应速率;
②利用平衡时各物质浓度计算化学平衡常数;
③转化的CO的浓度与起始浓度的比值获得CO的转化率;
④利用化学平衡状态特征判断;
⑤若保持其他条件不变,向原平衡体系中再充入3molCO,增大反应物浓度,化学平衡向正反应方向移动;化学平衡常数只与温度有关.
解答:
解:(1)①CH4(g)+H20(g)=C0(g)+3H2;由于生成1kg氢气需要吸收3.44×104 kJ热量,则生成3mol氢气吸收热量为:
×3mol=206.4kJ?mol-1,故答案为:CH4(g)+H20(g)=C0(g)+3H2△H=206.4kJ?mol-1;
②将CH4(g)+H20(g)=C0(g)+3H2△H=206.4kJ?mol-1与CO(g)+H2O(g)=CO2(g)+H2(g)△H=-41.0kJ?mol-1相加,可得到:CH4(g)+2H20(g)=CO2(g)+4H2(g)△H=+165.4 kJ?mol-1,故答案为:+165.4 kJ?mol-1;
(2)①利用0-4min内H2O的浓度变化为:△c(H2O)=(0.30-0.18)mol/L=0.12mol/L,v(H2O)=
=0.03mol/(L?min),故答案为:0.03mol/(L?min);
②平衡时,c(CO2)=c(H2)=△c(H2O)=0.12mol/L,c(H2O)=0.18mol/L,c(CO)=0.08mol/L,K=
=
=1,故答案为:1;
③△c(CO)=△c(H2O)=0.12mol/L,该反应达到平衡时CO的转化率为
×100%=60%,故答案为:60%;
④A、反应前后气体体积不变,压强不能判断是否达到化学平衡状态,故A错误;
B、混合气体中c(CO)不变,达到化学平衡状态,故B正确;
C、V(H2)正=V(H2O)逆,由于V(H2)逆=V(H2O)逆,所以V(H2)正=V(H2)逆,达到化学平衡状态,故C正确;
D、c(CO2)=c(CO),不能判断是否达到化学平衡状态,故D错误;
故选BC;
⑤若保持其他条件不变,向原平衡体系中再充入3molCO,增大反应物浓度,化学平衡向正反应方向移动;化学平衡常数只与温度有关,温度不变化学平衡常数不变,故答案为:正;不变.
| 3.44×104 kJ | ||
|
②将CH4(g)+H20(g)=C0(g)+3H2△H=206.4kJ?mol-1与CO(g)+H2O(g)=CO2(g)+H2(g)△H=-41.0kJ?mol-1相加,可得到:CH4(g)+2H20(g)=CO2(g)+4H2(g)△H=+165.4 kJ?mol-1,故答案为:+165.4 kJ?mol-1;
(2)①利用0-4min内H2O的浓度变化为:△c(H2O)=(0.30-0.18)mol/L=0.12mol/L,v(H2O)=
| 0.12mol/L |
| 4min |
②平衡时,c(CO2)=c(H2)=△c(H2O)=0.12mol/L,c(H2O)=0.18mol/L,c(CO)=0.08mol/L,K=
| c(CO2)?c(H2) |
| c(H2O)?c(CO) |
| 0.12mol/L×0.12mol/L |
| 0.18mol/L×0.08mol/L |
③△c(CO)=△c(H2O)=0.12mol/L,该反应达到平衡时CO的转化率为
| 0.12mol/L |
| 0.20mol/L |
④A、反应前后气体体积不变,压强不能判断是否达到化学平衡状态,故A错误;
B、混合气体中c(CO)不变,达到化学平衡状态,故B正确;
C、V(H2)正=V(H2O)逆,由于V(H2)逆=V(H2O)逆,所以V(H2)正=V(H2)逆,达到化学平衡状态,故C正确;
D、c(CO2)=c(CO),不能判断是否达到化学平衡状态,故D错误;
故选BC;
⑤若保持其他条件不变,向原平衡体系中再充入3molCO,增大反应物浓度,化学平衡向正反应方向移动;化学平衡常数只与温度有关,温度不变化学平衡常数不变,故答案为:正;不变.
点评:本题考查化学平衡图象、影响平衡的因素、平衡常数影响因素、化学反应速率的计算等,难度不大.

练习册系列答案
 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案
相关题目
下列说法不正确的是( )
| A、乙醇、乙烯都可被酸性高锰酸钾溶液氧化 |
| B、乙烯、苯都可与溴水发生加成反应 |
| C、乙醇、乙酸都可以发生酯化反应 |
| D、淀粉、油脂都可以发生水解反应 |
 由E(金属铁)制备的E(C5H5)2的结构如图甲所示,其中氢原子的化学环境完全相同.但早期人们却错误地认为它的结构如图乙所示.核磁共振法能区分这两种结构.图甲和图乙的核磁共振氢谱中含有的吸收峰分别为( )
由E(金属铁)制备的E(C5H5)2的结构如图甲所示,其中氢原子的化学环境完全相同.但早期人们却错误地认为它的结构如图乙所示.核磁共振法能区分这两种结构.图甲和图乙的核磁共振氢谱中含有的吸收峰分别为( )| A、1种 1种 |
| B、1种 2种 |
| C、1种 3种 |
| D、2种 3种 |
 在某一容积为2L的密闭容器中,A、B、C、D四种气体物质的量(n)随时间(t)的变化曲线如图所示:
在某一容积为2L的密闭容器中,A、B、C、D四种气体物质的量(n)随时间(t)的变化曲线如图所示: 在2L密闭容器内,800℃时反应:2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如表:
在2L密闭容器内,800℃时反应:2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如表: 化学反应速率与生产、生活密切相关.
化学反应速率与生产、生活密切相关.