题目内容
6.根据如图转化关系以及实验现象填写空白.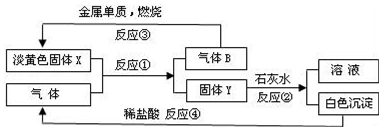
(1)固体X是Na2O2(填化学式)
(2)反应①的化学方程式是2Na2O2+2CO2=2Na2CO3+O2
(3)反应④的离子方程式是CaCO3+2H+=Ca2++CO2↑+H2O
(4)图中溶液的溶质是NaOH(填化学式),现有100mL含浓度均为1.0mol/L的MgCl2和AlCl3的混合溶液,要使其中的Mg2+全部转化为Mg(OH)2沉淀而分离出来,至少需要2.0mol/L该溶液的体积为300mL.
分析 金属单质燃烧生成淡黄色固体X,X是Na2O2,则B是2O2,金属单质是Na;Na2O2和气体反应生成氧气和固体Y,该气体是CO2,Y是Na2CO3;碳酸钠和氢氧化钙反应生成碳酸钙和氢氧化钠,所以白沉淀是CaCO3,得到NaOH溶液,以此解答该题.
解答 解:(1)通过以上分析知,固体X是Na2O2,故答案为:Na2O2;
(2)过氧化钠和二氧化碳反应生成碳酸钠和氧气,反应方程式为:2Na2O2+2CO2=2Na2CO3+O2;
故答案为:2Na2O2+2CO2=2Na2CO3+O2;
(3)碳酸钙和稀盐酸反应生成氯化钙、二氧化碳和水,离子方程式为:CaCO3+2 H+=Ca2++CO2↑+H2O,故答案为:CaCO3+2 H+=Ca2++CO2↑+H2O;
(4)由以上分析可知得到的溶液为NaOH,Mg2+、Al3+的物质的量分别为0.1L×1mol/L=0.1mol、0.1L×1mol/L=0.1mol,
由发生反应为MgCl2+2NaOH=Mg(OH)2↓+2NaCl
1 2
0.1mol 0.2mol
AlCl3+4NaOH=NaAlO2+3NaCl+2H2O,
1 4
0.1m ol 0.4mol
使Mg2+全部转化为沉淀分离出来,消耗的NaOH的物质的量为0.2mol+0.4mol=0.6mol,
至少需要2.0mol/L该溶液的体积为$\frac{0.6mol}{2.0mol/L}$=0.3L=300mL,
故答案为:NaOH;300.
点评 本题以元素化合物的推断为载体考查了离子方程式和化学方程式的书写,为高频考点,侧重考查学生的分析能力,能正确推断元素化合物是解本题的关键,注意规范书写离子方程式.

| A. | l mol OH-所含电子数为10NA | |
| B. | 2L0.5 mol•L-1Na2SO4溶液中阴离子所带电荷数为0.2NA | |
| C. | 标准状况下,1.12 L CC14含有的氯原子数为0.2NA | |
| D. | 14 g由CO和N2组成的混合气体中含有的分子总数为NA |
| A. | S2- | B. | Fe2+ | C. | SO32- | D. | K+ |
| A. | 新制氯水使有色布条褪色 | B. | 过氧化钠使某些染料褪色 | ||
| C. | SO2漂白纸浆 | D. | 活性炭使红墨水褪色 |
| A. | 1.4g | B. | 2.8g | C. | 5.6g | D. | 11.2g |
| A. | 苯分子中既含有碳碳单键,又含有碳碳双键 | |
| B. | CH4和C4H10一定为同系物 | |
| C. | 淀粉和纤维素是同分异构体 | |
| D. | 糖类、油脂、蛋白质都是天然高分子化合物 |
| A. | pH=3的0.1mol•L-1的NaHC2O4溶液中:c(H+)=c(OH)+c(C2O42-) | |
| B. | 0.1mol•L-1的(NH4)2S溶液中:c(NH4+)=2c(S2-)+2c(HS-)+2c(H2S) | |
| C. | pH=4的CH3COOH溶液中:$\frac{c(C{H}_{3}CO{O}^{-})}{c(O{H}^{-})•c(C{H}_{3}COOH)}$<1 | |
| D. | 等物质的量浓度,等体积的NaF溶液和HF溶液混合所得稀溶液中:c(H+)+c(HF)<c(F- )+2c(OH-) |
| A. | CH3CH2CH3 | B. | CH3CH2OH | C. | CH3CHO | D. | CH3OCH3 |