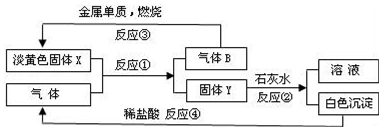
题目内容
17.某有机物含有C、H、O三种元素,其蒸气密度是相同条件下H2密度的29倍,把1.16g该有机物在O2中充分燃烧,将生成物通过足量碱石灰,碱石灰增重3.72g,又知生成的CO2和H2O的物质的量之比为1:1.该有机物可以使溴水褪色,能和金属钠发生反应生成H2,通过物理仪器测定其2个官能团且不在同一碳原子上,求:(1)该有机物的摩尔质量58g/mol.
(2)该有机物的分子式C3H6O.
(3)该有机物的结构简式CH2=CHCH2OH.
分析 蒸气密度是相同条件下H2密度的29倍,则相对分子质量为29×2=58,通过碱石灰增重为生成二氧化碳与水的质量,结合二者物质的量之比计算CO2和H2O的物质的量,再计算有机物的物质的量,根据原子守恒计算该有机物分子中C原子、H原子数目,再根据相对分子质量计算分子中O原子数目,以此确定分子式,该有机物可以使溴水褪色,能和金属钠发生反应生成H2,又2个官能团且不在同一碳原子上,以此可确定结构简式,以此解答该题.
解答 解:(1)蒸气密度是相同条件下H2密度的29倍,则相对分子质量为29×2=58,有机物的摩尔质量为58g/mol,故答案为:58;
(2)所取得有机物的物质的量为n=1.16g÷58g/mol=0.02mol,
根据题意,设燃烧生成CO2的为xmol,则H2O的也为xmol,
有44x+18x=3.72,解得:x=0.06
故有机物分子中含有C原子数目为$\frac{0.06mol}{0.02mol}$=3,含有H原子数目为$\frac{0.06mol×2}{0.02mol}$=6,
令有机物分子式为C3H6Om,又因为有机物分子量为58,则:36+6+16m=58,解得m=1,
故推得有机物分子式为C3H6O,
故答案为:C3H6O;
(3)该有机物的分子式为C3H6O,有机物可以使溴水褪色,说明含有碳碳双键,能和金属钠发生反应生成H2,则含有羟基,又2个官能团且不在同一碳原子上,故该有机物的结构简式为:CH2=CHCH2OH;
故答案为:CH2=CHCH2OH.
点评 本题考查有机物的推断,为高频考点,侧重考查学生的分析、计算能力,注意把握分子式与结构式的确定,注意掌握燃烧法利用原子守恒确定有机物分子组成,熟练掌握官能团的性质与转化.

练习册系列答案
 能考试期末冲刺卷系列答案
能考试期末冲刺卷系列答案
相关题目
8.在恒容密闭容器中发生下列反应:C(s)+CO2(g)?2CO(g)△H>0.下列有关该反应的描述正确的是( )
| A. | 容器内气体的压强不变,反应一定处于平衡状态 | |
| B. | 降低 C(CO)和增加C (s),均可以使平衡向正反应方向移动 | |
| C. | 其它条件一定时,升高温度和减小压强均不利于提高CO2转化率 | |
| D. | 在一定条件下,CO2的生成速率等于C(s)的生成速率时,反应一定处于平衡状态 |
5.相同质量的下列气体中电子数最少的是( )
| A. | O2 | B. | Cl2 | C. | N2 | D. | CO2 |
12.短周期元素X和Y可以形成XY4型化合物,若X的原子序数为m,Y的原子序数为n,则m和n的相互关系为( )
| A. | m+13=n | B. | n+5=m | C. | m+8=n | D. | n+11=m |
2.关于如图各装置图的叙述中,正确的是( )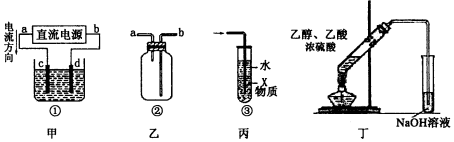

| A. | 装置丁可用于实验室制取并收集乙酸乙酯 | |
| B. | 装置乙可用于收集H2、NH3、CO2、Cl2、NO等气体 | |
| C. | 装置丙中X若为苯,可用于吸收氨气或氯化氢等易溶于水的气体,并能防止倒吸 | |
| D. | 装置甲中,d为阴极、c为阳极 |
9.下列离子方程式正确的是( )
| A. | 金属钠与水反应:Na+2H2O═Na++2OH-+H2↑ | |
| B. | 向AlCl3溶液中加入过量的NaOH溶液 Al3++3OH-═Al(OH)3↓ | |
| C. | Fe3O4与稀硝酸溶液反应:2Fe3O4+18H+═6Fe3++H2↑+8H2O | |
| D. | NaHSO4溶液与足量Ba(OH)2溶液混合:H++SO42-+Ba2++OH-═BaSO4↓+H2O |
7.下列说法正确的是( )
| A. | 一定条件下,乙酸乙酯、葡萄糖、蛋白质都能与水发生水解反应 | |
| B. | C3H6与C4H8一定互为同系物 | |
| C. | 全降解塑料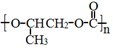 可由环氧丙烷 可由环氧丙烷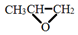 和CO2缩聚制得 和CO2缩聚制得 | |
| D. | 一定条件下,完全燃烧14g含氧质量分数为a的乙烯、乙醛混合气体,生成水的质量为18(1-a)g |