题目内容
11.常温时,下列溶液的pH大于8的是( )| A. | pH=6的盐酸用水稀释100倍 | |
| B. | pH=10的氨水用水稀释100倍 | |
| C. | pH=10的氢氧化钠溶液稀释1000倍 | |
| D. | 0.1 mol•L-1的硫酸100 mL跟0.2 mol•L-1 NaOH溶液100 mL完全反应 |
分析 A、酸溶液稀释后溶液的pH只能无限接近于7而不能大于7;
B、弱碱加水稀释时电离平衡被促进;
C、碱溶液稀释后溶液的pH只能无限接近于7而不能小于7;
D、先根据酸、碱反应计算剩余物质的酸碱性,再根据溶液中氢离子浓度计算溶液的pH值.
解答 解:A、酸溶液稀释后溶液的pH只能无限接近于7而不能大于7,pH=6的盐酸用水稀释100倍后溶液的pH无限接近于7,故A错误;
B、pH=10的氨水用水稀释100倍时,溶液的PH值大于8,故B正确;
C、pH=10的氢氧化钠溶液稀释1000倍时,溶液的pH值接近于7,故C错误;
D、设0.1mol•L-1的硫酸100mL和0.2mol•L-1NaOH溶液100mL混合后,两者恰好完全反应,故溶液显中性,故D错误;
故选B.
点评 本题考查了弱电解质的电离平衡的移动,应注意的是弱酸和弱碱加水稀释时,电离平衡被促进,pH的变化程度比强酸、强碱的小.

练习册系列答案
 鹰派教辅衔接教材河北教育出版社系列答案
鹰派教辅衔接教材河北教育出版社系列答案
相关题目
17.用于供应紧张,近两年全球铁矿砂价格连续上涨.下列有关铁及其化合物的说法中正确的是( )
| A. | 赤铁矿的主要成分是Fe3O4 | |
| B. | 高炉炼铁中炉渣的主要成分是硅酸钙 | |
| C. | 除去FeCl2溶液中的FeCl3杂质,可向溶液中加入足量铜粉,然后过滤 | |
| D. | Fe3+与KSCN溶液反应产生红色沉淀 |
18.季节交替、冷暖变化是人们着凉感冒的主要诱因,现市场治疗效果较好的速效感冒冲剂的主要成分之一为“对乙酰氨基酚”,其结构简式为 ,有关它的性质描述错误的是( )
,有关它的性质描述错误的是( )
 ,有关它的性质描述错误的是( )
,有关它的性质描述错误的是( )| A. | 与对硝基乙苯互为同分异构体 | |
| B. | 1mol该物质与浓溴水反应时最多消耗Br23mol | |
| C. | 它能与NaOH溶液反应 | |
| D. | 其水解产物之一对氨基苯酚( )具有弱酸性、弱碱性 )具有弱酸性、弱碱性 |
15.下列溶液中粒子数目最多的是( )
| A. | 60ml 0.1mol/L的HCl溶液 | B. | 30ml 0.1mol/L的AlCl3溶液 | ||
| C. | 20ml 0.1mol/L的MgCl2溶液 | D. | 10ml 0.2mol/L的FeCl3溶液 |
6.某羧酸酯的分子式为C18H26O5,1mol该酯完全水解得到1mol羧酸和2mol乙醇,该羧酸的分子式为( )
| A. | C16H25O5 | B. | C14H16O4 | C. | C14H18O5 | D. | C16H25O5 |
3.下列关于共价化合物的叙述正确的是( )
| A. | 共价键只存在于共价化合物中 | |
| B. | 共价化合物中既可能存在离子键,也可能存在共价键 | |
| C. | 共价化合物中一定存在共价键 | |
| D. | 共价化合物中可能存在共价键 |
20.下列有关物质用途的说法不正确的是( )
| A. | Na2O2用作呼吸面具的供氧剂 | B. | Al(OH)3用作制胃酸的中和剂 | ||
| C. | FeCl3用作铜制线路板的蚀刻剂 | D. | 浓硫酸用作NH3的干燥剂 |
1.下列有关离子反应的判断正确的是( )
| A. | 2Fe3++Fe═3Fe2+成立,说明氧化性:Fe3+>Fe2+ | |
| B. | SO2饱和溶液中NH4+、K+、CO32-、SO32-可大量存在 | |
| C. | 用NaOH溶液吸收尾气中的氯气:Cl2+4OH-═2ClO-+2H2O | |
| D. | 向NaHS溶液中加入适量硝酸发生反应:HS-+H+═H2S↑ |
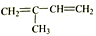 ⑤
⑤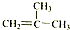 ⑥CH3CH(C2H5)CH2CH(C2H5)CH3 ⑦C5H10 ⑧ClCH=CHCl ⑨C5H4
⑥CH3CH(C2H5)CH2CH(C2H5)CH3 ⑦C5H10 ⑧ClCH=CHCl ⑨C5H4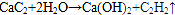 .
.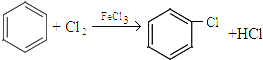 .
. .
.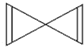 D.
D.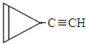 e.
e.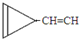 …
… 或
或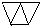 (只需答出一例的结构简式).
(只需答出一例的结构简式).