题目内容
11.类推是中学化学中重要的思维方法.下列类推结论正确的是( )| A. | SiH4的沸点高于CH4,推测HCl的沸点高于HF | |
| B. | Fe与CuSO4溶液反应置换出Cu,故Na也能从CuSO4溶液中置换出Cu | |
| C. | 电解熔融NaCl制取Na,故电解熔融MgCl2也能制取Mg | |
| D. | CO2和Na2O2反应生成Na2CO3和O2,故SO2和Na2O2反应生成Na2SO3和O2 |
分析 A.HF分子间含氢键;
B.Na先与水反应,再与硫酸铜反应;
C.Na、Mg均为活泼金属,利用电解法冶炼;
D.SO2和Na2O2发生氧化还原反应生成硫酸钠.
解答 解:A.HF分子间含氢键,HF的沸点高于HCl,而SiH4的沸点高于CH4,类推不合理,故A不选;
B.Na先与水反应,再与硫酸铜反应,不能置换出Cu,而Fe与CuSO4溶液反应置换出Cu,类推不合理,故B不选;
C.Na、Mg均为活泼金属,利用电解法冶炼,则电解熔融NaCl制取Na,故电解熔融MgCl2也能制取Mg,故C选;
D.SO2和Na2O2发生氧化还原反应生成硫酸钠,而CO2和Na2O2反应生成Na2CO3和O2,类推不合理,故D不选;
故选C.
点评 本题考查元素周期表与元素周期律的应用,为高频考点,把握元素的性质、元素周期律、元素化合物知识为解答的关键,侧重分析与应用能力的考查,注意规律性知识的应用,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
8.某温度下,将浓度都是0.1mol•L-1的X2、Y2两种气体充入至密闭容器中,使之发生反应生成气体Z,达到平衡时c(X2)=0.04mol•L-1、c(Y2)=0.08mol•L-1、c(Z)=0.04mol•L-1,则该反应的反应式是( )
| A. | X2+2Y2?XY2 | B. | 3X2+Y2?2X3Y | C. | 2X2+Y2?2X2Y | D. | X2+3Y2?2XY3 |
19.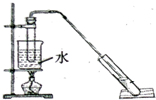 “酒是陈的香”,是因为酒在储存过程中生成了有香味的乙酸乙酯.某兴趣小组用无水乙醇和冰醋酸制备乙酸乙酯,相关物质的数据如下:
“酒是陈的香”,是因为酒在储存过程中生成了有香味的乙酸乙酯.某兴趣小组用无水乙醇和冰醋酸制备乙酸乙酯,相关物质的数据如下:
实验步骤如下:
①在试管里加入3mL乙醇;然后一边摇动,一边慢慢
加入2mL浓硫酸和2mL冰醋酸.再加入少量沸石.
②按照图示连接装置,水浴加热,使蒸气经导管通到饱和碳酸钠溶液的液面上.
③待小试管中收集约3mL产物时停止加热,撤出小试管并用力振荡,然后静置待其分层.
④分离出纯净的乙酸乙酯2.3mL.
(1)实验室制备乙酸乙酯的化学方程式为:CH3COOH+C2H5OH$?_{△}^{浓硫酸}$CH3COOC2H5+H2O
该反应的类型为取代反应;浓硫酸在此反应中的作用是催化剂和吸水剂.
(2)步骤①中加入沸石的目的是防止暴沸;步骤②采用水浴的优点是受热均匀.长导管的作用是冷凝回流.
(3)步骤③中饱和碳酸钠的作用是BD
A、中和乙酸和乙醇
B、中和乙酸并吸收部分乙醇
C、加速酯的生成,提高酯的产率
D、乙酸乙酯在饱和碳酸钠溶液中的溶解度比在水中更小,有利于分层析出.
(4)步骤④中需要用到的关键仪器是分液漏斗,乙酸乙酯应该从该仪器的上部流出(选择)
A、下部流出 B、上部流出 C、都可以
(5)计算可得乙酸乙酯的产率为67.2%(产率=实际产量/理论产量,保留三位有效数字)
(6)随着科技水平的提高,工业上生产乙酸乙酯时产率可能会不断提高.请问产率是否有可能达到100%不能(填“有可能”或“不可能”),理由是该反应是可逆反应,反应物不可能完全转化成生成物.
 “酒是陈的香”,是因为酒在储存过程中生成了有香味的乙酸乙酯.某兴趣小组用无水乙醇和冰醋酸制备乙酸乙酯,相关物质的数据如下:
“酒是陈的香”,是因为酒在储存过程中生成了有香味的乙酸乙酯.某兴趣小组用无水乙醇和冰醋酸制备乙酸乙酯,相关物质的数据如下:| 物质 | 乙醇 | 乙酸 | 乙酸乙酯 |
| 分子量 | 46 | 60 | 88 |
| 沸点(℃) | 78.5 | 117.9 | 77.1 |
| 密度(g/cm3) | 0.789 | 1.05 | 0.90 |
①在试管里加入3mL乙醇;然后一边摇动,一边慢慢
加入2mL浓硫酸和2mL冰醋酸.再加入少量沸石.
②按照图示连接装置,水浴加热,使蒸气经导管通到饱和碳酸钠溶液的液面上.
③待小试管中收集约3mL产物时停止加热,撤出小试管并用力振荡,然后静置待其分层.
④分离出纯净的乙酸乙酯2.3mL.
(1)实验室制备乙酸乙酯的化学方程式为:CH3COOH+C2H5OH$?_{△}^{浓硫酸}$CH3COOC2H5+H2O
该反应的类型为取代反应;浓硫酸在此反应中的作用是催化剂和吸水剂.
(2)步骤①中加入沸石的目的是防止暴沸;步骤②采用水浴的优点是受热均匀.长导管的作用是冷凝回流.
(3)步骤③中饱和碳酸钠的作用是BD
A、中和乙酸和乙醇
B、中和乙酸并吸收部分乙醇
C、加速酯的生成,提高酯的产率
D、乙酸乙酯在饱和碳酸钠溶液中的溶解度比在水中更小,有利于分层析出.
(4)步骤④中需要用到的关键仪器是分液漏斗,乙酸乙酯应该从该仪器的上部流出(选择)
A、下部流出 B、上部流出 C、都可以
(5)计算可得乙酸乙酯的产率为67.2%(产率=实际产量/理论产量,保留三位有效数字)
(6)随着科技水平的提高,工业上生产乙酸乙酯时产率可能会不断提高.请问产率是否有可能达到100%不能(填“有可能”或“不可能”),理由是该反应是可逆反应,反应物不可能完全转化成生成物.
6.根据如图所示的反应判断下列说法中错误的是( )
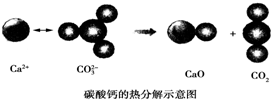

| A. | CO2(g)和CaO(s)的总能量大于CaCO3(s)的总能量 | |
| B. | 由该反应可推出凡是需要加热才发生的反应均为吸热反应 | |
| C. | 该反应的焓变大于零 | |
| D. | 该反应中有离子键断裂也有共价键断裂,化学键断裂吸收能量,化学键生成放出能量 |
16.小明体检的血液化验单中,葡萄糖为5.9mmol/L.表示该体检指标的物理量是( )
| A. | 物质的量 | B. | 物质的量浓度 | C. | 质量分数 | D. | 摩尔质量 |
 .
.