题目内容
6.根据如图所示的反应判断下列说法中错误的是( )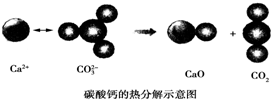
| A. | CO2(g)和CaO(s)的总能量大于CaCO3(s)的总能量 | |
| B. | 由该反应可推出凡是需要加热才发生的反应均为吸热反应 | |
| C. | 该反应的焓变大于零 | |
| D. | 该反应中有离子键断裂也有共价键断裂,化学键断裂吸收能量,化学键生成放出能量 |
分析 碳酸钙为离子化合物,受热分解生成二氧化碳和氧化钙,是吸热反应,反应物总能量高于生成物,断键吸收的能量高于成键释放的能量,且与反应条件无关,以此解答该题.
解答 解:A.反应吸热,生成物总能量高于反应物,故A正确;
B.反应是否放热与是否加热无关,如铝热反应放热,但需要在高温下进行,故B错误;
C.反应吸热.焓变大于零,故C正确;
D.碳酸钙中既有离子键又有共价键,其分解时既有离子键断裂又有共价键断裂,故D正确.
故选B.
点评 本题考查化学反应与能量变化,为高频考点,侧重于学生的分析能力的考查,注意把握相关概念的理解,难度不大.

练习册系列答案
 备战中考寒假系列答案
备战中考寒假系列答案
相关题目
3.浓盐酸和Ca(ClO)2能发生如下反应:Ca(ClO)2+4HCl(浓)=CaCl2+2Cl2+2H2O 用贮存很久的漂白粉与浓盐酸反应制得的氯气中,可能含有的杂质气体是( )
| A. | CO2、HC1、H2O | B. | HC1、H2O、O2 | C. | HC1、H2O | D. | CO2、O2 |
1.对比以下几个反应式:
Cl+Cl→Cl2△H1=-243kJ/mol;
O+O→O2△H2=-497kJ/mol;
N+N→N2△H3=-946kJ/mol.
你可以得出的结论是( )
Cl+Cl→Cl2△H1=-243kJ/mol;
O+O→O2△H2=-497kJ/mol;
N+N→N2△H3=-946kJ/mol.
你可以得出的结论是( )
| A. | 在常温下氮气比氧气和氯气稳定 | |
| B. | 氮、氧和氯的单质常温下为气体 | |
| C. | 氮、氧和氯分子在反应过程中释放能量 | |
| D. | 氮气、氧气和氯气的密度不同 |
11.类推是中学化学中重要的思维方法.下列类推结论正确的是( )
| A. | SiH4的沸点高于CH4,推测HCl的沸点高于HF | |
| B. | Fe与CuSO4溶液反应置换出Cu,故Na也能从CuSO4溶液中置换出Cu | |
| C. | 电解熔融NaCl制取Na,故电解熔融MgCl2也能制取Mg | |
| D. | CO2和Na2O2反应生成Na2CO3和O2,故SO2和Na2O2反应生成Na2SO3和O2 |
18.下列叙述正确的是( )
| A. | 组成元素相同,各元素质量分数也相同的不同物质属于同系物 | |
| B. | 分子式相同的不同物质一定是同分异构体 | |
| C. | 相对分子质量相同的不同物质一定是同分异构体 | |
| D. | 通式相同的不同物质一定属于同系物 |
15.下列哪项成果获得2016年诺贝尔化学奖( )
| A. | 中国科学家屠呦呦成功提取出青蒿素用于治疗疟疾,挽救许人的生命 | |
| B. | 法国的让彼埃尔索瓦等三位科学家成功研制出分子机器 | |
| C. | 美国的三位科学家在拓扑相变领域的突出贡献 | |
| D. | 中国科学家蔡启瑞院士非酶催化剂合成氨以及化学方面突碳一出贡献 |