题目内容
在373k时把11.5g N2O4气体通入体积为500mL的真空容器中,立即出现红棕色.反应进行到2s时,NO2的含量为0.01mol.进行到60s时达到平衡,此容器内混合气体的密度是氢气密度的28.75倍,则
(1)开始2 s内以N2O4表示的反应速度为多少?
(2)达到平衡时,体系的压强为开始的多少倍?
(3)平衡时还有N2O4多少mol?
(1)开始2 s内以N2O4表示的反应速度为多少?
(2)达到平衡时,体系的压强为开始的多少倍?
(3)平衡时还有N2O4多少mol?
考点:化学平衡的计算
专题:化学平衡专题
分析:11.5g N2O4气体物质的量=
=0.125mol
(1)由N2O4?2NO2,反应进行到2s时,NO2含量为0.01mol,则N2O4减少0.005mol,结合v=
计算反应速率;
(2)根据压强之比等于物质的量之比计算;
(3)60s时达到平衡,此时容器内混合气体密度是氢气密度的28.75倍,则混合气体的平均摩尔质量为28.75×2=57.5g/mol,
N2O4?2NO2,
开始 0.125 0
转化 x 2x
平衡 0.125-x 2x
则
=57.5g/mol,
解得x=0.075mol,以此计算物质的量.
| 11.5g |
| 92g/mol |
(1)由N2O4?2NO2,反应进行到2s时,NO2含量为0.01mol,则N2O4减少0.005mol,结合v=
| △c |
| △t |
(2)根据压强之比等于物质的量之比计算;
(3)60s时达到平衡,此时容器内混合气体密度是氢气密度的28.75倍,则混合气体的平均摩尔质量为28.75×2=57.5g/mol,
N2O4?2NO2,
开始 0.125 0
转化 x 2x
平衡 0.125-x 2x
则
| 92g/mol×(0.125-x)+46g/mol×2x |
| 0.125-x+2x |
解得x=0.075mol,以此计算物质的量.
解答:
解:11.5g N2O4气体物质的量=
=0.125mol
(1)由N2O4?2NO2,反应进行到2s时,NO2含量为0.01mol,则N2O4减少0.005mol,由v=
=
=0.005 mol?L-1?S-1,
答:开始2s内,以N2O4表示的反应速率为0.005 mol?L-1?S-1;
(2)计算可知,开始总物质的量为0.125mol,平衡时总物质的量为0.125+0.075=0.2mol,
由压强之比等于物质的量之比可知,达平衡时,体系的压强是开始时的
=1.6倍,
答:达平衡时,体系的压强是开始时的1.6倍;
(3)60s时达到平衡,此时容器内混合气体密度是氢气密度的28.75倍,则混合气体的平均摩尔质量为28.75×2=57.5g/mol,
N2O4?2NO2,
开始0.125 0
转化 x 2x
平衡0.125-x 2x
则
=57.5g/mol,
解得x=0.075mol,则N2O4的平衡物质的量=0.125mol-0.075mol=0.05mol;
答:平衡时还有N2O40.05mol.
| 11.5g |
| 92g/mol |
(1)由N2O4?2NO2,反应进行到2s时,NO2含量为0.01mol,则N2O4减少0.005mol,由v=
| △c |
| △t |
| ||
| 2s |
答:开始2s内,以N2O4表示的反应速率为0.005 mol?L-1?S-1;
(2)计算可知,开始总物质的量为0.125mol,平衡时总物质的量为0.125+0.075=0.2mol,
由压强之比等于物质的量之比可知,达平衡时,体系的压强是开始时的
| 0.2mol |
| 0.125mol |
答:达平衡时,体系的压强是开始时的1.6倍;
(3)60s时达到平衡,此时容器内混合气体密度是氢气密度的28.75倍,则混合气体的平均摩尔质量为28.75×2=57.5g/mol,
N2O4?2NO2,
开始0.125 0
转化 x 2x
平衡0.125-x 2x
则
| 92g/mol×(0.125-x)+46g/mol×2x |
| 0.125-x+2x |
解得x=0.075mol,则N2O4的平衡物质的量=0.125mol-0.075mol=0.05mol;
答:平衡时还有N2O40.05mol.
点评:本题考查化学平衡及化学反应速率的计算,题目难度中等,明确信息中的平均摩尔质量的计算是解答的关键,并熟悉化学反应速率的计算式及化学平衡三段法计算即可解答.

练习册系列答案
 寒假天地重庆出版社系列答案
寒假天地重庆出版社系列答案
相关题目
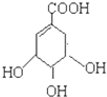
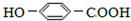 ),其反应是
),其反应是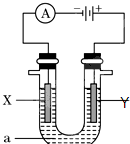 电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:
电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题: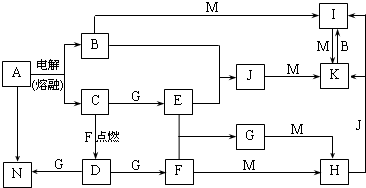
 和
和 两种,为对其结构进行物理方法鉴定,可用
两种,为对其结构进行物理方法鉴定,可用 ,则红外光谱中有
,则红外光谱中有