题目内容
请根据反应:Cu+2FeCl3=CuCl2+2FeCl2,设计一个原电池.
(1)画出装置图,标明两极材料和电解质溶液,并指出正、负极.
(2)写出两电极上的电极反应式.
(1)画出装置图,标明两极材料和电解质溶液,并指出正、负极.
(2)写出两电极上的电极反应式.
考点:原电池和电解池的工作原理
专题:电化学专题
分析:该反应中Fe元素化合价由+3价变为+2价、Cu元素化合价由0价变为+2价,发生氧化反应的金属Cu作负极、不如Cu活泼的金属或导电的非金属作正极,FeCl3为电解质,
据此设计原电池.
据此设计原电池.
解答:
解:(1)根据电池反应式知,Fe元素化合价由+3价变为+2价、Cu元素化合价由0价变为+2价,所以Cu作负极,不如铜活泼的金属或导电的非金属作正极,如C,FeCl3溶液为电解质溶液,其装置图为 ,故答案为:
,故答案为: ;
;
(2)由方程式可知,Cu被氧化,为原电池的负极,负极反应为Cu-2e-=Cu2+,正极Fe3+被还原,电极方程式为2Fe3++2e-=2Fe2+,
答:负极电极反应式为:Cu-2e-=Cu2+;正极电极反应为:2Fe3++2e-=2Fe2+.
 ,故答案为:
,故答案为: ;
;(2)由方程式可知,Cu被氧化,为原电池的负极,负极反应为Cu-2e-=Cu2+,正极Fe3+被还原,电极方程式为2Fe3++2e-=2Fe2+,
答:负极电极反应式为:Cu-2e-=Cu2+;正极电极反应为:2Fe3++2e-=2Fe2+.
点评:本题考查了原电池设计,这是新课标要求学生需要掌握的内容,正确判断原电池正负极材料、电解质溶液是设计原电池难点,一般来说,还原剂作负极,不如负极活泼的金属或非金属导体作正极,氧化剂的溶液作电解质溶液.

练习册系列答案
相关题目
下列试剂能够用来鉴别KNO3溶液和KCl溶液的是( )
| A、AgNO3溶液 |
| B、稀盐酸 |
| C、BaCl2溶液 |
| D、NaOH溶液 |
等体积等物质的量浓度的硫酸,氢氧化钠溶液分别放在甲、乙两烧杯中,各加等质量的铝,生成氢气的体积比为4:5,则甲、乙两烧杯中的反应情况可能分别是( )
| A、甲、乙中都是铝过量 |
| B、甲中铝过量,乙中碱过量 |
| C、甲中酸过量,乙中铝过量 |
| D、甲中酸过量,乙中碱过量 |
阿斯匹林的结构简式为 ,则1摩尔阿斯匹林和足量的NaOH溶液充分反应,消耗NaOH的物质的量为( )
,则1摩尔阿斯匹林和足量的NaOH溶液充分反应,消耗NaOH的物质的量为( )
 ,则1摩尔阿斯匹林和足量的NaOH溶液充分反应,消耗NaOH的物质的量为( )
,则1摩尔阿斯匹林和足量的NaOH溶液充分反应,消耗NaOH的物质的量为( )| A、1摩 | B、2摩 | C、3摩 | D、4摩 |
下列有关物质的分类正确的是( )
| A、混合物:空气、矿泉水、水银 |
| B、碱:Ba(OH)2、纯碱、NH3?H2O |
| C、盐:石灰石、氯化铵、NaHSO4 |
| D、酸性氧化物:CO2、CO、SO2 |
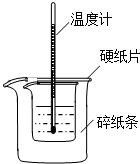 利用如图装置测定中和热的实验步骤如下:
利用如图装置测定中和热的实验步骤如下: