题目内容
用“<”或“>”回答下列问题:
(1)金属性:Na K B Al Ca Mg
(2)非金属性:S Cl P Cl S O
(3)酸性:H2CO3 H2SiO3,H2SiO3 H3PO4
(4)碱性:Ca(OH)2 Mg(OH)2,Mg(OH)2 Al(OH)3.
(1)金属性:Na
(2)非金属性:S
(3)酸性:H2CO3
(4)碱性:Ca(OH)2
考点:金属在元素周期表中的位置及其性质递变的规律,非金属在元素周期表中的位置及其性质递变的规律,元素周期律的作用
专题:元素周期律与元素周期表专题
分析:(1)同一周期元素,元素的金属性随着原子序数增大而减弱;同一主族元素,金属的金属性随着原子序数增大而增强;
(2)同一周期元素,元素的非金属性随着原子序数增大而增强,同一主族元素,元素的非金属性随着原子序数增大而减弱;
(3)元素的非金属性越强,其最高价氧化物的水化物酸性越强;
(4)元素的金属性越强,其最高价氧化物的水化物碱性越强.
(2)同一周期元素,元素的非金属性随着原子序数增大而增强,同一主族元素,元素的非金属性随着原子序数增大而减弱;
(3)元素的非金属性越强,其最高价氧化物的水化物酸性越强;
(4)元素的金属性越强,其最高价氧化物的水化物碱性越强.
解答:
解:(1)同一周期元素,元素的金属性随着原子序数增大而减弱;同一主族元素,金属的金属性随着原子序数增大而增强,所以金属性:Na<K、B<Al、Ca>Mg,故答案为:<;<;>;
(2)同一周期元素,元素的非金属性随着原子序数增大而增强,同一主族元素,元素的非金属性随着原子序数增大而减弱,所以非金属性:S<Cl、P<Cl、S<O,故答案为:<;<;<;
(3)非金属性C>Si、Si<P,所以酸性:H2CO3>H2SiO3、H2SiO3<H3PO4,故答案为:>;<;
(4)金属性Ca>Mg、Mg>Al,所以碱性:Ca(OH)2>Mg(OH)2,Mg(OH)2>Al(OH)3,故答案为:>;>.
(2)同一周期元素,元素的非金属性随着原子序数增大而增强,同一主族元素,元素的非金属性随着原子序数增大而减弱,所以非金属性:S<Cl、P<Cl、S<O,故答案为:<;<;<;
(3)非金属性C>Si、Si<P,所以酸性:H2CO3>H2SiO3、H2SiO3<H3PO4,故答案为:>;<;
(4)金属性Ca>Mg、Mg>Al,所以碱性:Ca(OH)2>Mg(OH)2,Mg(OH)2>Al(OH)3,故答案为:>;>.
点评:本题考查了元素周期律知识,明确同一周期、同一主族元素周期律知识即可解答,知道元素金属性强弱与其最高价氧化物的水化物碱性关系、元素非金属性强弱与其最高价氧化物的水化物酸性强弱关系,题目难度不大.

练习册系列答案
相关题目
下列离子方程式书写正确的是( )
| A、明矾溶液中加入过量的氨水A13++4NH3?H2O=AlO2-+4NH4++2H2O |
| B、乙酸溶液中加入少量碳酸氢铵溶液CH3COOH十HCO3-=CH3COO-+CO2↑+H2O |
| C、在FeI2溶液中滴入少量溴水2Fe2++4I-+3Br2=2Fe3++2I2+6Br- |
| D、碳酸钠溶液中逐滴加入与之等物质的量的盐酸:CO32-+2H+=CO2↑+H2O |
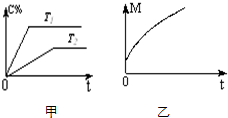 在密闭容器中投入一定量的A和B发生反应:m A(g)+n B(g)?p C(g)+q D(g).
在密闭容器中投入一定量的A和B发生反应:m A(g)+n B(g)?p C(g)+q D(g).