题目内容
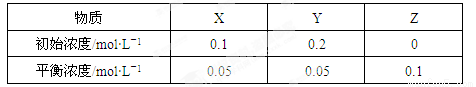
在25℃时,密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如下表。下列说法错误的是
A.反应达到平衡时,X的转化率为50%
B.改变温度可以改变此反应的平衡常数
C.反应可表示为X+3Y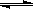 2Z,其平衡常数为1600
2Z,其平衡常数为1600
D.增大压强使平衡向生成Z的方向移动,平衡常数增大
C
【解析】
试题分析: 由表中数据可计算,X、Y、Z三种气体的转化浓度分别为0.05 mol·L-1,0.15 mol·L-1,0.1 mol·L-1,故X的转化率为 ×100%=50%,A对;X、Y、Z的化学计量系数之比=0.05:0.15:0.1=1:3:2,平衡常数=
×100%=50%,A对;X、Y、Z的化学计量系数之比=0.05:0.15:0.1=1:3:2,平衡常数= ,B对;增大压强,平衡正向移动,但是平衡常数不变,平衡常数只与温度有关,C错D对。答案选C。
,B对;增大压强,平衡正向移动,但是平衡常数不变,平衡常数只与温度有关,C错D对。答案选C。
考点:考查化学平衡常数的意义。

(12分)已知某反应在不同条件下的反应历程可以表示成下图,
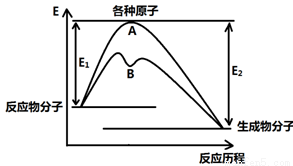
E1表示反应物分子变成原子所吸收的热量,E2表示这些原子重新成键形成生成物放出的热量,请回答下列问题:
(1)据图判断该反应是 (填“吸”或“放”)热反应,如该反应可逆,则其达到平衡后,其他条件不变,升高温度,反应物的转化率 (填“增大”、“减小”或“不变”),其中B历程表明此反应改变的条件为 (填字母)。
A.增大反应物的浓度 B.降低温度 C.增大压强 D.使用催化剂
(2)下表给出了一些化学键的键能:
化学键 | H—H | Cl—Cl | O=O | O—H | H—Cl |
键能(kJ·mol-1) | 436 | 247 | x | 463 | 431 |
①若图中表示反应H2(g) +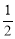 O2(g)=H2O(g) ΔH= - 241.8 kJ·mol-1,则x= kJ·mol-1(保留一位小数)。
O2(g)=H2O(g) ΔH= - 241.8 kJ·mol-1,则x= kJ·mol-1(保留一位小数)。
②催化剂、加热条件下可用氧气与氯化氢气体反应置换出氯气,同时生成另一种气态化合物,利用上表数据写出该热化学方程式 ,当该反应中有1 mol电子发生转移时,图像中历程A的E1= kJ(保留一位小数)。
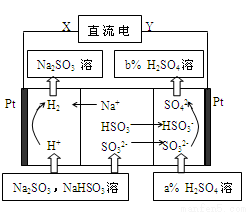
 2AgCl + H2↑能进行,设计了下列四个实验,如下图所示,你认为可行的方案是:
2AgCl + H2↑能进行,设计了下列四个实验,如下图所示,你认为可行的方案是: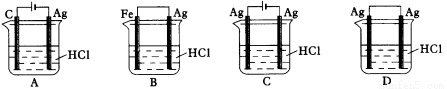
 2AB(g)达到平衡的标志是(NA代表阿伏加德罗常数)
2AB(g)达到平衡的标志是(NA代表阿伏加德罗常数)