题目内容
19.下列物质中,可一次性鉴别乙酸、乙醇、苯及氢氧化钡溶液的是( )| A. | 氢氧化钠溶液 | B. | 溴水 | C. | 碳酸钠溶液 | D. | 紫色石蕊溶液 |
分析 乙酸具有酸性、氢氧化钡具有碱性,遇石蕊变色不同,且乙酸与碳酸钠反应生成气体,氢氧化钡与碳酸钠反应生成白色沉淀,结合物质的溶解性及分层现象来解答.
解答 解:A.氢氧化钠溶液不能鉴别乙酸、乙醇、氢氧化钡,故A错误;
B.溴水与乙酸、乙醇不反应且混溶,无法鉴别,故B错误;
C.碳酸钠溶液与乙酸溶液反应产生气泡,与乙醇不反应但混溶,与苯不反应但溶液分层,与氢氧化钡溶液反应产生白色沉淀,现象各不相同,可鉴别,故C正确;
D.加入紫色石蕊溶液,乙酸呈红色,乙醇无现象,苯分层,氢氧化钡呈蓝色,可鉴别,故D正确;
故选CD.
点评 本题考查有机物的鉴别,为高频考点,把握官能团与性质的关系、有机反应等为解答的关键,侧重分析与应用能力的考查,注重知识迁移应用能力的训练,注意性质的异同及反应现象,题目难度不大.

练习册系列答案
相关题目
1.下列实验现象可用同一原理解释的是( )
| A. | 向品红溶液中分别通入SO2和Cl2,品红均褪色 | |
| B. | 向裂化汽油和苯乙烯中分别加入溴水,溴水均褪色 | |
| C. | 分别加热盛有氯化铵和单质碘的试管,内壁或管口均有固体凝结 | |
| D. | 分别向鸡蛋白溶液中加入饱和硫酸铵溶液和甲醛溶液,均有固体析出 |
10.草酸(H2C2O4)与高锰酸钾在酸性条件下能够发生如下反应:2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O
【实验1】甲同学用8.00mL 0.001mol/L KMnO4溶液与5.00mL 0.01mol/LH2C2O4溶液反应,研究不同条件对化学反应速率的影响.改变的条件如下:
(1)如果研究温度对化学反应速率的影响,可用实验Ⅰ和Ⅱ作对比(用Ⅰ~Ⅲ表示).
(2)对比实验Ⅰ和Ⅲ,可以研究c(H+)(或硫酸溶液的浓度)对化学反应速率的影响,实验Ⅲ中加入2.00mL蒸馏水的目的是确保实验中c(KMnO4)、c(H2C2O4)不变和总体积不变,可使Ⅰ和Ⅲ中硫酸浓度不同.
【实验2】乙同学在研究草酸与高锰酸钾在酸性条件下反应的影响因素时发现,草酸与酸性高锰酸钾溶液开始一段时间反应速率较慢,溶液褪色不明显,但不久后突然褪色,反应速率明显加快.
(1)针对上述现象,乙同学认为草酸与高锰酸钾反应放热,导致溶液温度升高,反应速率加快.从影响化学反应速率的因素看,你猜想还可能是催化剂的影响.
(2)若用实验证明你的猜想,除了酸性高锰酸钾溶液和草酸溶液外,还需要选择的试剂最合理的是D(填字母).A.硫酸钾 B.水 C.二氧化锰 D.硫酸锰.
【实验1】甲同学用8.00mL 0.001mol/L KMnO4溶液与5.00mL 0.01mol/LH2C2O4溶液反应,研究不同条件对化学反应速率的影响.改变的条件如下:
| 组别 | KMnO4溶液 /ml | H2C2O4溶液 /ml | 10%硫酸体积/mL | 温度/℃ | 其他物质 |
| Ⅰ | 8.00 | 5.00 | 3.00 | 20 | |
| Ⅱ | 8.00 | 5.00 | 3.00 | 30 | |
| Ⅲ | 8.00 | 5.00 | 1.00 | 20 | 2.00 mL 蒸馏水 |
(2)对比实验Ⅰ和Ⅲ,可以研究c(H+)(或硫酸溶液的浓度)对化学反应速率的影响,实验Ⅲ中加入2.00mL蒸馏水的目的是确保实验中c(KMnO4)、c(H2C2O4)不变和总体积不变,可使Ⅰ和Ⅲ中硫酸浓度不同.
【实验2】乙同学在研究草酸与高锰酸钾在酸性条件下反应的影响因素时发现,草酸与酸性高锰酸钾溶液开始一段时间反应速率较慢,溶液褪色不明显,但不久后突然褪色,反应速率明显加快.
(1)针对上述现象,乙同学认为草酸与高锰酸钾反应放热,导致溶液温度升高,反应速率加快.从影响化学反应速率的因素看,你猜想还可能是催化剂的影响.
(2)若用实验证明你的猜想,除了酸性高锰酸钾溶液和草酸溶液外,还需要选择的试剂最合理的是D(填字母).A.硫酸钾 B.水 C.二氧化锰 D.硫酸锰.
14.下列关于元素周期律的叙述正确的是( )
| A. | 随着元素原子序数的递增,原子最外层电子总是从1到8重复出现 | |
| B. | 随着元素原子序数的递增,原子半径从大到小(稀有气体除外)发生周期性变化 | |
| C. | 随着元素原子序数的递增,元素最高正价从+1到+7、负价从-7到-1重复出现 | |
| D. | 元素性质的周期性变化是指原子核外电子排布的周期性变化、原子半径的周期性变化 |
4.下列有机物的命名正确的是( )
| A. |  2.3-二乙基丁烷 | B. |  2-丁醇 | C. |  二氯丙烷 | D. |  3-甲基-2-丁烯 |
11.Y元素最高正价与负价的绝对值之差是6;Y元素与M元素形成离子化合物,并在水中电离出电子层结构相同的离子,该化合物是( )
| A. | KCl | B. | NaF | C. | Na2O | D. | NaCl |
8.银锌钮扣高能电池放电时的反应为:Zn+Ag2O═ZnO+2Ag,下列说法中不正确的是( )
| A. | 若电解质溶液为KOH溶液,则电池工作一段时间后pH有明显变化 | |
| B. | Zn作负极,被氧化 | |
| C. | Ag2O在正极上发生还原反应 | |
| D. | 电解质溶液中的阴离子移向负极 |
9.如图为元素周期表短周期中的一部分,有关元素X、Y、Z、M的说法不正确的是( )
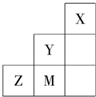

| A. | M、Z可形成ZM2分子 | B. | X原子最外层达到8电子结构 | ||
| C. | 原子半径:Z>M>Y | D. | Z2-的结构示意图可表示为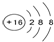 |
 氮的化合物在无机化工领域有着重要的地位.请回答下列问题:
氮的化合物在无机化工领域有着重要的地位.请回答下列问题: