题目内容
17.A、B、C、D、E、F、G为中学常见物质.其中A、B、C常温下为气体,A是空气主要成分,B是摩尔质量最小的气体.D、E为金属单质,且D常用于国防工业,E为红色固体,(反应条件和其他生成物省略).转化关系图如下:
(1)A、F、G的化学式分别为N2、Mg3N2、CuO
(2)C的水溶液呈碱性 (酸性、碱性),原因NH3•H2O?NH4++OH- (用离子方程式表示)
(3)工业上制备金属D的化学方程式为MgCl2 $\frac{\underline{\;电解\;}}{\;}$Mg+Cl2↑
(4)C+G→E的化学方程式3CuO+2NH3$\frac{\underline{\;\;△\;\;}}{\;}$3Cu+3H2O+N2
(5)E单质加入稀硫酸加热无现象,通入一定量氧气,溶液呈蓝色,用化学方程式表示反应原理2Cu+O2+2H2SO4 $\frac{\underline{\;\;△\;\;}}{\;}$2CuSO4+2H2O.
分析 A、B、C常温下为气体,A是空气主要成分,B是摩尔质量最小的气体,则A为N2,B为H2,所以C为NH3,E为金属单质且为红色固体,则E为Cu,所以G为CuO,能与氮气反应的金属为镁,所以D为Mg,F为Mg3N2,据此答题.
解答 解:A、B、C常温下为气体,A是空气主要成分,B是摩尔质量最小的气体,则A为N2,B为H2,所以C为NH3,E为金属单质且为红色固体,则E为Cu,所以G为CuO,能与氮气反应的金属为镁,所以D为Mg,F为Mg3N2,
(1)根据上面的分析可知,A为N2,F为Mg3N2,G为CuO,
故答案为:N2;Mg3N2;CuO;
(2)C为NH3,C的水溶液呈碱性,离子方程式为NH3•H2O?NH4++OH-,
故答案为:碱性;NH3•H2O?NH4++OH-;
(3)D为Mg,工业上用电解氯化镁的方法制备金属镁,反应的化学方程式为MgCl2 $\frac{\underline{\;电解\;}}{\;}$Mg+Cl2↑,
故答案为:MgCl2 $\frac{\underline{\;电解\;}}{\;}$Mg+Cl2↑;
(4)C+G→E的化学方程式为3CuO+2NH3$\frac{\underline{\;\;△\;\;}}{\;}$3Cu+3H2O+N2,
故答案为:3CuO+2NH3$\frac{\underline{\;\;△\;\;}}{\;}$3Cu+3H2O+N2;
(5)E为Cu,E单质加入稀硫酸加热无现象,通入一定量氧气,溶液呈蓝色,生成硫酸铜,化学方程式为2Cu+O2+2H2SO4 $\frac{\underline{\;\;△\;\;}}{\;}$2CuSO4+2H2O,
故答案为:2Cu+O2+2H2SO4 $\frac{\underline{\;\;△\;\;}}{\;}$2CuSO4+2H2O.
点评 本题考查无机物推断,以物质颜色、物质状态、物质的存在结合转化关系采用正逆结合的方法进行推断,侧重考查了氮、镁、铜等元素及其化合物的知识,镁与氮气反应为本题的易错点.

 培优三好生系列答案
培优三好生系列答案 优化作业上海科技文献出版社系列答案
优化作业上海科技文献出版社系列答案| A. | K值越大,表明该反应越有利于C的生成 | |
| B. | 若缩小反应器的容积,能使平衡正向移动,则K增大 | |
| C. | 温度越高,K一定越大 | |
| D. | 如果m+n=p,则K=1 |
| A. | Mg2C3水解生成C3H4 | B. | Li2C2水解生成C2H4 | ||
| C. | Al4C3水解生成C3H4 | D. | ZnC2水解生成C2H |
| A. | 电解饱和食盐水时,阴极的电极反应式为:2Cl--2e-═Cl2↑ | |
| B. | 钢铁发生电化学腐蚀的正极反应式:Fe-2e-═Fe2+ | |
| C. | 粗铜精炼时,与电源负极相连的是纯铜,电极反应式为:Cu2++2e-═Cu | |
| D. | 氢氧燃料电池的负极反应式:O2+2H2O+4e-═4OH- |
| A. | CH2Cl-CH2Cl 二氯丁烯 | B. | CH3CH2CH(CH3)2 2-甲基丁烷 | ||
| C. | 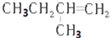 3-甲基丁烯 3-甲基丁烯 | D. | 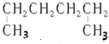 1,4-二甲基丁烷 1,4-二甲基丁烷 |
已知:
| 密度(g/cm3) | 熔点(℃) | 沸点(℃) | 溶解性 | |
| 环己醇 | 0.96 | 25 | 161 | 能溶于水 |
| 环己烯 | 0.81 | -103 | 83 | 难溶于水 |
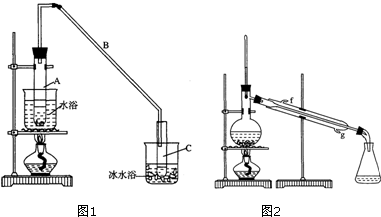
(1)制备粗品
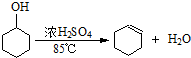
将12.5mL环己醇加入试管A中,再加入1mL浓硫酸,摇匀后放入碎瓷片,缓慢加热至反应完全,在试管C内得到环己烯粗品.
①导管B除了导气外还具有的作用是冷凝.
②加热试管A采用热水浴,而非直接加热.目的是控制温度85℃左右,防止环己醇挥发,使受热均匀,试管C置于冰水浴中的目的是冷凝环己烯,防止其挥发.
(2)制备精品
①环己烯粗品中含有环己醇和少量酸性杂质等.加入饱和食盐水,振荡、静置、分层,环己烯在上 层(填“上”或“下”),分液后用C(填入编号)洗涤.
A.KMnO4溶液 B.稀H2SO4 C.Na2CO3溶液
②再将环己烯按图2装置蒸馏,冷却水从g口进入(填字母).
③收集产品时,控制的温度应在83℃左右,实验制得的环己烯精品质量低于理论产量,可能的原因是C.
A.蒸馏时从70℃开始收集产品
B.环己醇实际用量多了
C.制备粗品时环己醇随产品一起蒸出
(3)制环己烯时,由于浓硫酸的强氧化性,还产生少量SO2、CO2及水蒸气,该小组用以下试剂检验
 、SO2、CO2及水蒸气,混合气体通过试剂的顺序是④⑤①⑤②③(或④⑤①⑤③②) (填序号)
、SO2、CO2及水蒸气,混合气体通过试剂的顺序是④⑤①⑤②③(或④⑤①⑤③②) (填序号)①和Na2SO3溶液 ②酸性KMnO4溶液 ③石灰水 ④无水CuSO4 ⑤品红溶液.





 ;
; .
.