题目内容
17.下列混合气体和水反应时,一种气体的体积减少,另一种气体的体积增加的是( )| A. | 二氧化氮和一氧化氮 | B. | 氢气和氧气 | ||
| C. | 氧气和二氧化氮 | D. | 氯气和氧气 |
分析 H2、O2、NO均难溶于水,NO2与水反应生成硝酸和NO,氧气不溶于水,以此来解答.
解答 解:A.NO不溶于水,NO2与水反应生成硝酸和NO,则二氧化氮减少,NO体积增大,故A选;
B.氢气和氧气均难溶于水,不符合一种气体的体积减少,另一种气体的体积增加,故B不选;
C.氧气和二氧化氮和水反应,二氧化氮与水反应生成硝酸和NO,则二氧化氮减少,但氧气不变,故C不选;
D.通入水中,氯气和水发生反应Cl2+H2O=HCl+HClO,不能满足其中一种气体体积增大,故D不选;
故选A.
点评 本题考查物质的性质,综合考查元素化合物知识,为高频考点,把握物质的性质及发生的反应为解答的关键,侧重分析与应用能力的考查,题目难度不大.

练习册系列答案
 全能练考卷系列答案
全能练考卷系列答案
相关题目
7.下列离子在溶液中因发生氧化还原反应而不能大量共存的是( )
| A. | H+、Na+、Cl- | B. | H+、Ag+、Cl- | C. | Na+、H+、NO3- | D. | Fe2+、H+、NO3- |
8.在主族元素中,X元素位于第二周期,且分别与Y、Z、W三元素相邻,X、Y的原子序数之和等于Z的原子序数,这四种元素原子的最外层电子数之和为20.下列判断正确的是( )
| A. | 原子序数:Z<Y<X<W | |
| B. | X、Y、Z、W形成的单质最多有6种 | |
| C. | X元素最高价氧化物对应水化物的化学式为:HXO3 | |
| D. | 四种元素的气态氢化物中,W的气态氢化物最稳定 |
5.下列反应的离子方程式书写中,正确的是( )
| A. | 金属钾溶于水:2K+2H2O═2K++OH-+H2↑ | |
| B. | 小苏打溶液中加入少量NaOH溶液:H++OH-═H2O | |
| C. | FeCl3溶液与铜反应:Fe3++Cu═Fe2++Cu2+ | |
| D. | 硫酸溶液中加入氢氧化钡溶液至中性:Ba2++OH-+H++SO42-═BaSO4↓+H2O |
12.实验室用下图所示装置制备氯气并进行一系列相关的实验(夹持设备已省略).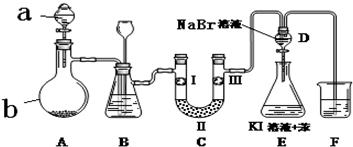
(1)a、b两仪器的名称:a分液漏斗;b蒸馏烧瓶.
(2)洗气装置B是为了除去Cl2中的HCl气体,应放入的试剂是饱和食盐水;同时装置B亦是安全瓶,监测实验进行时C中是否发生堵塞,请写出发生堵塞时B中的现象B中长颈漏斗中液面上升,形成水柱.
(3)制备氯气选用的药品为:漂粉精固体【主要成分为Ca(ClO)2】和浓盐酸,相关的化学反应方程式为Ca(ClO)2+4HCl(浓)=CaCl2+2Cl2↑+2H2O.
(4)装置C的实验目的是验证氯气是否具有漂白性,为此C中I、II、III依次放入c.
(5)设计装置D、E的目的是比较氯、溴、碘的非金属性.当向D中缓缓通入一定量氯气时,可以看到无色溶液逐渐变为黄色,说明氯的非金属性大于溴(填“大于”或“小于”).
(6)F处为烧碱溶液,写出吸收Cl2的离子方程式Cl2+2OH-=Cl-+ClO-+H2O.

(1)a、b两仪器的名称:a分液漏斗;b蒸馏烧瓶.
(2)洗气装置B是为了除去Cl2中的HCl气体,应放入的试剂是饱和食盐水;同时装置B亦是安全瓶,监测实验进行时C中是否发生堵塞,请写出发生堵塞时B中的现象B中长颈漏斗中液面上升,形成水柱.
(3)制备氯气选用的药品为:漂粉精固体【主要成分为Ca(ClO)2】和浓盐酸,相关的化学反应方程式为Ca(ClO)2+4HCl(浓)=CaCl2+2Cl2↑+2H2O.
(4)装置C的实验目的是验证氯气是否具有漂白性,为此C中I、II、III依次放入c.
| a | b | c | d | |
| I | 干燥的有色布条 | 干燥的有色布条 | 湿润的有色布条 | 湿润的有色布条 |
| II | 碱石灰 | 硅胶 | 无水氯化钙 | 浓硫酸 |
| III | 湿润的有色布条 | 湿润的有色布条 | 干燥的有色布条 | 干燥的有色布条 |
(6)F处为烧碱溶液,写出吸收Cl2的离子方程式Cl2+2OH-=Cl-+ClO-+H2O.
2.短周期主族元素X、Y、Z、W原子序数依次增大,X原子最外层有4个电子,Y是地壳中含量最高的元素,Z在周期表中处于周期序数等于族序数的位置,W的单质广泛用作半导体材料.下列叙述正确的是( )
| A. | X、Y、Z、W四种元素的最外层电子数之和为18 | |
| B. | 原子半径由大到小的顺序:W>Z>Y>X | |
| C. | 单质的熔点:W>Z | |
| D. | 简单气态氢化物的稳定性:X>Y>W |
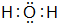 .
.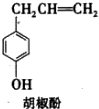 胡椒酚是植物挥发油中的一种成分.关于胡椒酚的下列说法:
胡椒酚是植物挥发油中的一种成分.关于胡椒酚的下列说法: