题目内容
5.下列反应的离子方程式书写中,正确的是( )| A. | 金属钾溶于水:2K+2H2O═2K++OH-+H2↑ | |
| B. | 小苏打溶液中加入少量NaOH溶液:H++OH-═H2O | |
| C. | FeCl3溶液与铜反应:Fe3++Cu═Fe2++Cu2+ | |
| D. | 硫酸溶液中加入氢氧化钡溶液至中性:Ba2++OH-+H++SO42-═BaSO4↓+H2O |
分析 A.反应生成KOH和氢气;
B.小苏打为碳酸氢钠,二者反应生成碳酸钠和水;
C.电子、电荷不守恒;
D.不符合离子的配比.
解答 解:A.金属钾溶于水的离子反应为2K+2H2O═2K++OH-+H2↑,故A正确;
B.小苏打溶液中加入少量NaOH溶液的离子反应为HCO3-+OH-═CO32-+H2O,故B错误;
C.FeCl3溶液与铜反应的离子反应为2Fe3++Cu═2Fe2++Cu2+,故C错误;
D.硫酸溶液中加入氢氧化钡溶液至中性的离子反应为Ba2++2OH-+2H++SO42-═BaSO4↓+2H2O,故D错误;
故选A.
点评 本题考查离子反应方程式书写的正误判断,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重分析与应用能力的考查,注意离子反应中保留化学式的物质及电子、电荷守恒,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
13.水是人类赖以生存的物质.H2O的摩尔质量的数值是( )
| A. | 16 | B. | 18 | C. | 20 | D. | 22 |
20.下列表示中不正确的是( )
| A. | 1 mol氧 | B. | 1 mol H | C. | 1 mol CO32- | D. | 1 mol NaCl |
10.下列实验操作、现象和结论均正确的是( )
| 选项 | 实验操作 | 现象 | 结论 |
| A | 淀粉溶液中加稀硫酸,加热片剂,滴加银氨溶液,再水浴加热 | 无银镜生成 | 淀粉未发生水解 |
| B | 将一铝箔放在酒精灯外焰上灼烧 | 铝箔熔化但不滴落 | 铝箔表面生成致密的Al2O3薄膜,且Al2O3熔点高于Al |
| C | 铜放入稀硫酸中,再加入硝酸钠固体 | 开始无明显现象,后溶液变蓝,有明显的气泡放出,铜溶解 | 硝酸钠可以加快铜与稀硫酸的反应速率 |
| D | 向2mL0.1mol/LNa2S溶液中滴加几滴0.1mol/LZnSO4溶液;再加入几滴0.1mol/LCuSO4溶液 | 先生成白色沉淀,后生成黑色沉淀 | 溶度积(Ksp):ZnS>CuS |
| A. | A | B. | B | C. | C | D. | D |
17.下列混合气体和水反应时,一种气体的体积减少,另一种气体的体积增加的是( )
| A. | 二氧化氮和一氧化氮 | B. | 氢气和氧气 | ||
| C. | 氧气和二氧化氮 | D. | 氯气和氧气 |
14.有机物在反应中,常有下列原子间的共价键全部或部分断裂,如C-H、C-C、C═C、C-O、C═O、O-H等.下列各反应中,反应物分子中断裂的键和反应类型对应正确的是( )
| 化学反应 | 加成反应 | 乙酸酯化 | 乙醇酯化 | 乙醇的催化氧化 |
| A | C=C | C-O | O-H | C-H、O-H |
| B | C=C | C-O | O-H | C-O |
| C | C-C | C=O | C-O | C-H |
| D | C=C | C-O | C-O | C-C |
| A. | A | B. | B | C. | C | D. | D |
15.下列实验操作中,能用于互不相溶液体分离的是( )
| A. |  | B. |  | C. |  | D. |  |

 ;
;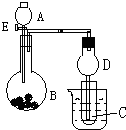 用如图所示装置进行实验,将A逐滴加入B中:
用如图所示装置进行实验,将A逐滴加入B中: